У вас тут два разных отношения (отношение сил и отношение плеч), и для каждого в таблице написано, что на что делить:
- отношение сил: делим силу F₁ на силу F₂
- отношение плеч: делим длину плеча на длину плеча
Несмотря на то, что это два разных отношения, но по свойству рычага, оба эти отношения должны быть равны друг другу.
опыт №1
отношение сил:
отношение плеч:
опыт №2
отношение сил:
отношение плеч:
опыт №3
отношение сил:
отношение плеч:
Всё, записываем все вычисленные значения в таблицу (в третьем опыте можно записать обыкновенной дробью точное значение 2/3 либо десятичной- приближённое значение 0,67 или ещё можно записать в виде бесконечной периодической десятичной дроби 0,(6) если вы такое проходили, конечно).
Как видим, в каждом опыте оба отношения равны друг другу. Что и требовалось доказать.
Твердые тела передают оказываемое на них давление в направлении действия силы. В отличие от твердых тел, жидкости и газы передают производимое на них давление по всем направлениям одинаково. Это объясняется тем, что отдельные частицы и слои жидкости и газа могут свободно перемещаться по всем направлениям. Свойство жидкости и газа передавать производимое на них давление одинаково во все стороны наглядно демонстрируется в опыте Паскаля. При в движении поршня в трубку вода выталкивается из всех отверстий одинаково, а не только из тех, которые расположены в направлении силы давления поршня. Если шар Паскаля вместо воды заполнить дымом, результат будет тот же.
Отношение находится делением одного на другое.
У вас тут два разных отношения (отношение сил и отношение плеч), и для каждого в таблице написано, что на что делить:
- отношение сил: делим силу F₁ на силу F₂
- отношение плеч: делим длину плеча на длину плеча
Несмотря на то, что это два разных отношения, но по свойству рычага, оба эти отношения должны быть равны друг другу.
опыт №1
отношение сил: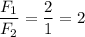
отношение плеч: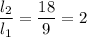
опыт №2
отношение сил: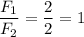
отношение плеч: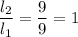
опыт №3
отношение сил: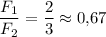
отношение плеч: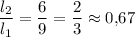
Всё, записываем все вычисленные значения в таблицу (в третьем опыте можно записать обыкновенной дробью точное значение 2/3 либо десятичной- приближённое значение 0,67 или ещё можно записать в виде бесконечной периодической десятичной дроби 0,(6) если вы такое проходили, конечно).
Как видим, в каждом опыте оба отношения равны друг другу. Что и требовалось доказать.