Объяснение:
V₁ = 3 л
V₂ = 6 л
p₂ = 10 кПа
p₁ - ?
По закону Бойля-Мариотта:
p₁·V₁ = p₂·V₂
p₁ = (V₂/V₁)·p₂
p₁ = (6/3)·10 = 20 кПа
Замечание: Здесь мы не переводили в СИ, поскольку имеем дело с ОТНОШЕНИЕМ однородных величин.
20кПа
Дано:
V1=3л=3*10^-3 м3
V2=6л=6*10^-3 м3
P2=10кПа=10*10^3 Па
Уравнение, описывающее состояние идеального газа – это уравнение Менделеева-Капейрона.
PV=vRT
У нас было два состояние
P1*V1=v*R*T1
P2*V2=v*R*T2
Так как процесс изотермический (при постоянной температуре произошло изменение состояние газа), то T1 = T2 = Т
P1*V1=v*R*T
P2*V2=v*R*T
Так как правые части уравнение равны между собой, то и левые части должны быть равны
P1*V1= P2*V2
Выразим отсюда P1
P1= P2*V2/ V1
Подставим
P1= = 20*10^3 Па=20кПа
Объяснение:
V₁ = 3 л
V₂ = 6 л
p₂ = 10 кПа
p₁ - ?
По закону Бойля-Мариотта:
p₁·V₁ = p₂·V₂
p₁ = (V₂/V₁)·p₂
p₁ = (6/3)·10 = 20 кПа
Замечание: Здесь мы не переводили в СИ, поскольку имеем дело с ОТНОШЕНИЕМ однородных величин.
20кПа
Объяснение:
Дано:
V1=3л=3*10^-3 м3
V2=6л=6*10^-3 м3
P2=10кПа=10*10^3 Па
Уравнение, описывающее состояние идеального газа – это уравнение Менделеева-Капейрона.
PV=vRT
У нас было два состояние
P1*V1=v*R*T1
P2*V2=v*R*T2
Так как процесс изотермический (при постоянной температуре произошло изменение состояние газа), то T1 = T2 = Т
P1*V1=v*R*T
P2*V2=v*R*T
Так как правые части уравнение равны между собой, то и левые части должны быть равны
P1*V1= P2*V2
Выразим отсюда P1
P1= P2*V2/ V1
Подставим
P1=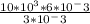 = 20*10^3 Па=20кПа
= 20*10^3 Па=20кПа