на заряд 1 мккл движущийся со скоростью 1000 км/с в магнитном поле действует сила 0,1 н заряд движется под углом 30 градусов к направлению индукции магнитного поля. Чему равна индукция этого поля?
, где сила Архимеда , ρ₁ - плотность воды, V₁ - объем погруженной части тела, P - вес тела.
Для одной льдины закон Архимеда:
(1) , здесь ρ₁ - плотность воды, m₂ - масса льда, ρ₂ - плотность льда, S - площадь горизонального сечения льдины, h₁ - глубина погружения льдины в воду, h - высота льдины.
Отсюда: (2) см
Для льдины с медным кубиком:
(3) , m₂ - масса льда, m₃ - масса медного кубика, h₂ - глубина погружения льдины в воду с установленным медным кубиком.
Подставляем сюда вместо m₂ выражение 1, получаем:
(4) , где h₂-h₁ =Δh
Теперь запишем закон Архимеда для льдины с железным кубиком:
, m₂ - масса льда, m₄ - масса железного кубика, H - глубина погружения льдины в воду с установленным железным кубиком.
Подставляем сюда выражение 1:
(5) .
Выразим массу железного кубика через массу медного:
, a - длина ребра куба, ρ₄ - плотность железа.
, тогда:
(6)
Подставляя (6), (4) в (5):
Упрощая это выражение и подставляя из (2) значение h₁:
Понятие валентности формировалось вместе с понятием химической связи, и его содержание неоднократно расширялось и изменялось.
В начале 19 в. Дж. Дальтоном был сформулирован закон кратных отношений, из которого следовало, что каждый атом одного элемента может соединяться с определенным числом атомов другого элемента. В середине 19 в., когда были определены точные относительные веса атомов (И. Я. Берцелиус и др.), стало ясно, что число таких связей не превышает определённой величины и зависит от природы атома. Например, атом F может соединяться лишь с одним атомом Н, О — с двумя. Эта связывать или замещать определённое число других атомов и была названа «валентностью» (Э. Франкленд, 1853).
В конце 50-х гг. 19 в. А. С. Купер и А. Кекуле постулировали принцип постоянной четырёхвалентности углерода в органических соединениях. Представления о валентности составили важную часть теории химического строения А. М. Бутлерова (1861). Молекулы стали изображать с структурных формул, получивших особенно широкое распространение в органической химии.
Периодический закон Д. И. Менделеева (1869) вскрыл зависимость валентности элемента от его положения в периодической системе. Элементы одной группы обладают одинаковой высшей валентностью, в большинстве случаев равной номеру группы. Эта зависимость сыграла чрезвычайно важную роль в развитии химии: зная лишь положение элемента в периодической системе, можно было предсказать состав его соединений и впоследствии синтезировать их.
В 1916 Г. Льюис постулировал, что химическая связь осуществляется парой электронов, принадлежащих одновременно обоим взаимодействую-щим атомам. В 1917 В. Коссель выдвинул гипотезу, согласно которой электронная пара связи переходит целиком к одному из атомов с образованием ионной пары катион — анион, удерживающихся в молекуле электростатическими силами. Согласно обеим гипотезам, валентность атома в соединении стала определяться числом его неспаренных электронов, участвующих в связях, а максимальная валентность — полным числом электронов в валентной оболочке атома, то есть номером труппы.
В настоящее время синтезировано большое число разнообразных химических соединений, состав которых не подчиняются простым правилам валентности: координационные соединения, π-комплексы, «нульвалентные» соединения. Поэтому задача нахождения единого определения валентности представляется крайне сложной.
57,5 см
Объяснение:
Закон Архимеда:
Для одной льдины закон Архимеда:
(1)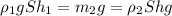 , здесь ρ₁ - плотность воды, m₂ - масса льда, ρ₂ - плотность льда, S - площадь горизонального сечения льдины, h₁ - глубина погружения льдины в воду, h - высота льдины.
, здесь ρ₁ - плотность воды, m₂ - масса льда, ρ₂ - плотность льда, S - площадь горизонального сечения льдины, h₁ - глубина погружения льдины в воду, h - высота льдины.
Отсюда: (2)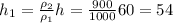 см
см
Для льдины с медным кубиком:
(3)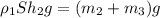 , m₂ - масса льда, m₃ - масса медного кубика, h₂ - глубина погружения льдины в воду с установленным медным кубиком.
, m₂ - масса льда, m₃ - масса медного кубика, h₂ - глубина погружения льдины в воду с установленным медным кубиком.
Подставляем сюда вместо m₂ выражение 1, получаем:
(4)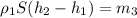 , где h₂-h₁ =Δh
, где h₂-h₁ =Δh
Теперь запишем закон Архимеда для льдины с железным кубиком:
Подставляем сюда выражение 1:
(5)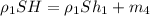 .
.
Выразим массу железного кубика через массу медного:
(6)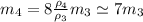
Подставляя (6), (4) в (5):
Упрощая это выражение и подставляя из (2) значение h₁:
Понятие валентности формировалось вместе с понятием химической связи, и его содержание неоднократно расширялось и изменялось.
В начале 19 в. Дж. Дальтоном был сформулирован закон кратных отношений, из которого следовало, что каждый атом одного элемента может соединяться с определенным числом атомов другого элемента. В середине 19 в., когда были определены точные относительные веса атомов (И. Я. Берцелиус и др.), стало ясно, что число таких связей не превышает определённой величины и зависит от природы атома. Например, атом F может соединяться лишь с одним атомом Н, О — с двумя. Эта связывать или замещать определённое число других атомов и была названа «валентностью» (Э. Франкленд, 1853).
В конце 50-х гг. 19 в. А. С. Купер и А. Кекуле постулировали принцип постоянной четырёхвалентности углерода в органических соединениях. Представления о валентности составили важную часть теории химического строения А. М. Бутлерова (1861). Молекулы стали изображать с структурных формул, получивших особенно широкое распространение в органической химии.
Периодический закон Д. И. Менделеева (1869) вскрыл зависимость валентности элемента от его положения в периодической системе. Элементы одной группы обладают одинаковой высшей валентностью, в большинстве случаев равной номеру группы. Эта зависимость сыграла чрезвычайно важную роль в развитии химии: зная лишь положение элемента в периодической системе, можно было предсказать состав его соединений и впоследствии синтезировать их.
В 1916 Г. Льюис постулировал, что химическая связь осуществляется парой электронов, принадлежащих одновременно обоим взаимодействую-щим атомам. В 1917 В. Коссель выдвинул гипотезу, согласно которой электронная пара связи переходит целиком к одному из атомов с образованием ионной пары катион — анион, удерживающихся в молекуле электростатическими силами. Согласно обеим гипотезам, валентность атома в соединении стала определяться числом его неспаренных электронов, участвующих в связях, а максимальная валентность — полным числом электронов в валентной оболочке атома, то есть номером труппы.
В настоящее время синтезировано большое число разнообразных химических соединений, состав которых не подчиняются простым правилам валентности: координационные соединения, π-комплексы, «нульвалентные» соединения. Поэтому задача нахождения единого определения валентности представляется крайне сложной.