нужно!
Построить рисунки, учитывая показатели:
1 рисунок:
Фокусное расстояние (3 см)
Расстояние от главной оптической оси до источника (2 см)
2 рисунок:
Фокусное расстояние (3 см)
Расстояние от главной оптической оси до источника (2, 5 см)
Задание 2.На рисунках указать главную оптическую ось, тип линзы.
Задание 3. Провести замечательные лучи так (любые 2), чтобы получить изображение в линзе. Подписать лучи (первый, второй или третий)
Задание 4. Указать, какое изображение – мнимое или действительное, прямое или перевёрнутое.
Масса автомобиля: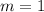 т =
т = 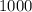 кг.
кг.
Начальная скорость автомобиля: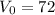 км/ч =
км/ч = 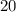 м/с.
м/с.
Конечная скорость автомобиля: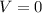 м/с.
м/с.
Так как автомобиль остановится.
Коэффициент трения: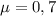 .
.
Найти нужно тормозной путь: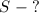
Решение:0. Строим рисунок для упрощения определения направлений сил.
1. Распишем второй закон Ньютона по оси Оy: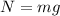 .
.
2. Распишем второй закон Ньютона по оси Ох: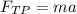 .
.
3. Сила трения по определению:
4. Объединим (1) и (3):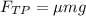 .
.
5. Объединим (2) и (4):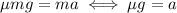 .
.
6. Скорость при равнозамедленном движении: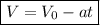
С учётом того, что конечная скорость равна нулю, получим: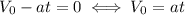 .
.
7. Объединяем (5) и (6):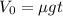 .
.
8. Выразим время из (7):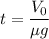 .
.
9. Тормозной путь: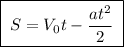
10. Объединяем (5), (8) и (9):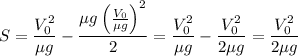 .
.
Численно получим: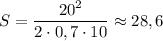 (м).
(м).
ответ: 28,6 м.Более простой по закону сохранения энергии.
Концентрация – это количество структурных элементов (частиц: молекул, атомов, ионов и т. п.) в единице объема однородной системы:
n N V , (1.1)
здесь N – число структурных элементов, составляющих тело (систему); V –
объем системы. Единица концентрации в СИ:
3
n м
.
Количеством вещества тела (системы) называется величина равная:
N N A
, (1.2)
где 23 1
6 02 N , 10 моль A
– постоянная (число) Авогадро, численно равная количеству атомов, содержащихся в 12 г углерода 12 С . Единица количества вещества в СИ является одной из основных единиц: моль . Таким образом,
моль – это такое количество вещества, в котором содержится число структурных частиц равное числу Авогадро.
Атомной единицей массы (а. е. м.) называется единица массы mед равная 1 12 массы атома изотопа углерода 12 С : m кг ед
27 1,66 10
.
Относительной атомной массой (сокращенно – атомной массой) Ar
химического элемента называется отношение массы атома этого элемента к
а. е. м.:
Ar mат mед . (1.3)
Относительной молекулярной массой (сокращенно – молекулярной массой) М r
химического вещества называется отношение массы молекулы этого
вещества к а.е.м.:
М r mмол mед . (1.3*
)
r Mr A и – являются безразмерными величинами, при этом
i
r i Ar i M n ,
,
где ni – число атомов i-го химического элемента, входящего в состав молекулы
данного вещества; Ar,i – относительная атомная масса этого элемента.
Молярной массой вещества (обозначается µ или М) называется масса
одного моля m , здесь m – масса химически однородного тела (системы);
– количество вещества этого тела, отсюда следует (сравните с (1.2)):
m . (1.4)
Относительные атомные массы (усредненные по природным изотопам)
приводятся в таблице Д. И. Менделеева. Молярная масса связана с относительной молекулярной массой Mr вещества соотношением:
M кг моль r 0,001
Объяснение: