Объяснение:
4. PV=(m/M)*R*T - уравнение Менделеева-Клапейрона
По-условию P=const, V=const
V=(m*R*ΔT)/P*M, т.е. прямая зависимость между объёмом и изменением температуры: при увеличении температуры - увеличивается объём
ρ=m/V
PVM=mRT
m/V=PM/RT => ρ=PM/RT, обратная зависимость, т.е. при увеличении температуры - уменьшается плотность.
E=3/2*k*T: опять таки прямая зависимость, т.е. при увеличении температуры - внутренняя энергии растёт.
5. U=3/2*m/M*R*T - первый закон термодинамики
U=PV (из формулы Менделеева-Клапейрона PV=3/2*m/M*R*T)
Отсюда U=PM/ρ => ρ=PM/U
ρ=(96**8*)/4*=192 г/
Объяснение:
4. PV=(m/M)*R*T - уравнение Менделеева-Клапейрона
По-условию P=const, V=const
V=(m*R*ΔT)/P*M, т.е. прямая зависимость между объёмом и изменением температуры: при увеличении температуры - увеличивается объём
ρ=m/V
PVM=mRT
m/V=PM/RT => ρ=PM/RT, обратная зависимость, т.е. при увеличении температуры - уменьшается плотность.
E=3/2*k*T: опять таки прямая зависимость, т.е. при увеличении температуры - внутренняя энергии растёт.
5. U=3/2*m/M*R*T - первый закон термодинамики
U=PV (из формулы Менделеева-Клапейрона PV=3/2*m/M*R*T)
Отсюда U=PM/ρ => ρ=PM/U
ρ=(96*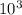 *8*
*8*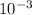 )/4*
)/4*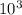 =192 г/
=192 г/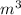
Выразим V из закона Менделеева-Клапейрона:
P V = m R T / M => V = m R T / P M.
А теперь приравняем V1 к V2. И дабы не писать лишнего, сразу посмотрим, что у нас сократится: M, R, m (но сначала я напишу с m для ясности). Получаем:
m T1 / P1 = 0,4 m T2 / P2.
У тебя сейчас, наверное, возник вопрос: почему во второй части уравнения перед m стоит 0,4?
- Потому что исходя из условия задачи мы можем сделать вывод, что m2 = 0,4 m1 (в уравнении m1 заменена на просто m для краткости).
Теперь сокращаем массы, выводим P2:
P2 = 0,4 T2 P1 / T1 = 4*10^-1 * 273 * 2*10^5 / 3*10^2 = 72,8*10^3 Па