За какое время испарится - не скажу, а разницу поясню.
Разберемся для начала, что, собственно такое – испарение. Испарением назовем процесс, когда молекула тела (жидкого) приобретает кинетическую энергию достаточную, для совершения работы по преодолению силы притяжения остальных молекул (это называется работа выхода) отрывается от жидкости и уходит в атмосферу. Естественно, речь идет о молекулах, которые находятся на поверхности жидкости (испарение в воздушные пузыри в жидкости при кипении не рассматриваем, хотя это в принципе одно и то же). Работа выхода у разных жидкостей разная, потому что силы притяжения разные. Кинетическую энергию молекула приобретает за счет нагрева (повышения температуры) жидкости и за счет столкновений с другими молекулами. Значит интенсивность испарения зависит от температуры тела прямо пропорционально. То есть, одна и та же жидкость в одинаковых количествах испарится быстрее там где теплее. И чем разность температур больше, тем больше отличаются скорости испарения.
В принципе этого достаточно для ответа. Дальше тем, кому интересно.
Испарившиеся молекулы не сразу удаляются от поверхности на расстояния, достаточные, что бы уже не вернуться в жидкость. И за счет столкновений с молекулами атмосферы и другими молекулами жидкости возвращаются частично в жидкость. И таких молекул тем больше, чем больше молекул скопилось над жидкостью. То есть, для воды, чем больше относительная влажность воздуха над поверхностью воды, тем больше доля вернувшихся молекул. Что понижает скорость испарения жидкости. Но при одном и том же количестве молекул воды в объеме воздуха, относительная влажность тем ниже, чем выше температура среды. Иначе говоря, при более высоких температурах окружающей среды, количество испарившихся молекул должно быть больше, что бы доля возвращающихся молекул стала такой же, как у жидкости с низкой температурой, находящейся в более низкотемпературной среде. При некоторых условиях, например в закрытом сосуде, наступает момент, когда количества испаряющихся и возвращающихся молекул становятся равными, наступает так называемое динамическое равновесие. Оно может наступить и в открытом сосуде, и тем раньше, чем больше относительная влажность воздуха. То есть жидкость вроде и испаряется, но столько же молекул возвращается назад. Что бы изменить ситуацию, достаточно насильственно убрать испарившиеся молекулы от поверхности (сдуть, например). И возникает интересная ситуация. Более горячая жидкость, где много молекул отрывается от поверхности, в итоге будет испаряться медленнее, чем холодная жидкость, поверхность которого обдувают воздухом, содержащим мало молекул воды.
По второму закону Ньютона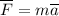
Составим уравнения для обоих тел и спроэцируем его на ось х
(рисунок даю, но он выполнен не акуратно прощения)
По горизонтали на тело 1 действуют сила тяги F, направленная в правую сторону и сила натяжения нити Т - влево
поэтому проэкция уравнение сил действующих на тело 1 на ось х имеет вид
По горизонтали на тело 2 действуют сила натяжения нити Т направленная вправо
поэтому проэкция уравнение сил действующих на тело 2 на ось х имеет вид
Найдем из вторго уравнения а и подставим в первое
Разберемся для начала, что, собственно такое – испарение. Испарением назовем процесс, когда молекула тела (жидкого) приобретает кинетическую энергию достаточную, для совершения работы по преодолению силы притяжения остальных молекул (это называется работа выхода) отрывается от жидкости и уходит в атмосферу. Естественно, речь идет о молекулах, которые находятся на поверхности жидкости (испарение в воздушные пузыри в жидкости при кипении не рассматриваем, хотя это в принципе одно и то же). Работа выхода у разных жидкостей разная, потому что силы притяжения разные. Кинетическую энергию молекула приобретает за счет нагрева (повышения температуры) жидкости и за счет столкновений с другими молекулами. Значит интенсивность испарения зависит от температуры тела прямо пропорционально. То есть, одна и та же жидкость в одинаковых количествах испарится быстрее там где теплее. И чем разность температур больше, тем больше отличаются скорости испарения.
В принципе этого достаточно для ответа. Дальше тем, кому интересно.
Испарившиеся молекулы не сразу удаляются от поверхности на расстояния, достаточные, что бы уже не вернуться в жидкость. И за счет столкновений с молекулами атмосферы и другими молекулами жидкости возвращаются частично в жидкость. И таких молекул тем больше, чем больше молекул скопилось над жидкостью. То есть, для воды, чем больше относительная влажность воздуха над поверхностью воды, тем больше доля вернувшихся молекул. Что понижает скорость испарения жидкости. Но при одном и том же количестве молекул воды в объеме воздуха, относительная влажность тем ниже, чем выше температура среды. Иначе говоря, при более высоких температурах окружающей среды, количество испарившихся молекул должно быть больше, что бы доля возвращающихся молекул стала такой же, как у жидкости с низкой температурой, находящейся в более низкотемпературной среде. При некоторых условиях, например в закрытом сосуде, наступает момент, когда количества испаряющихся и возвращающихся молекул становятся равными, наступает так называемое динамическое равновесие. Оно может наступить и в открытом сосуде, и тем раньше, чем больше относительная влажность воздуха. То есть жидкость вроде и испаряется, но столько же молекул возвращается назад. Что бы изменить ситуацию, достаточно насильственно убрать испарившиеся молекулы от поверхности (сдуть, например). И возникает интересная ситуация. Более горячая жидкость, где много молекул отрывается от поверхности, в итоге будет испаряться медленнее, чем холодная жидкость, поверхность которого обдувают воздухом, содержащим мало молекул воды.