Скорость - есть производная расстояния. График представляет собой прямую с уравнением , где - абсцисса точки пересечения графика функции с осью Ot (z = const). Тогда (1), что и есть проекция скорости в любое время на ось Ox. По рисунку видно, что (2). Отбросим положительные ответы, т.к. при подстановке в уравнение (1) они дают отрицательное z, что неверно по условию (2). Подставим в уравнение (1) , тогда из получим , что подходит по условию (2). Убедимся, что ответ не : , откуда , что не удовлетворяет условию (2).
Парціа́льний тиск (від лат. partialis — частковий) — внесок газу певного роду в загальний тиск суміші газів і відповідає тиску, під яким перебував би газ, що входить до складу газової суміші, коли б він один займав об'єм, рівний об'ємові суміші при тій самій температурі.
Парціальний тиск окремої складової частини (компонента) суміші, якщо її можна вважати ідеальним газом, визначається за формулою:
де {\displaystyle \nu _{i}}{\displaystyle \nu _{i}} — кількість речовини даної (і-тої) компоненти, R — газова стала, T і V — відповідно, температура та об'єм суміші.
Згідно із законом Дальтона у випадку ідеальних газів парціальні тиски окремих компонентів суміші газів сумуються
-0,6 м/c
Объяснение:
Скорость - есть производная расстояния. График представляет собой прямую с уравнением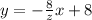 , где
, где  - абсцисса точки пересечения графика функции с осью Ot (z = const). Тогда
- абсцисса точки пересечения графика функции с осью Ot (z = const). Тогда 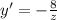 (1), что и есть проекция скорости в любое время на ось Ox. По рисунку видно, что
(1), что и есть проекция скорости в любое время на ось Ox. По рисунку видно, что 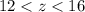 (2). Отбросим положительные ответы, т.к. при подстановке в уравнение (1) они дают отрицательное z, что неверно по условию (2). Подставим в уравнение (1)
(2). Отбросим положительные ответы, т.к. при подстановке в уравнение (1) они дают отрицательное z, что неверно по условию (2). Подставим в уравнение (1) 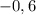 , тогда из
, тогда из 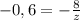 получим
получим 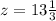 , что подходит по условию (2). Убедимся, что ответ не
, что подходит по условию (2). Убедимся, что ответ не 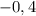 :
: 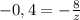 , откуда
, откуда 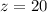 , что не удовлетворяет условию (2).
, что не удовлетворяет условию (2).
Парціа́льний тиск (від лат. partialis — частковий) — внесок газу певного роду в загальний тиск суміші газів і відповідає тиску, під яким перебував би газ, що входить до складу газової суміші, коли б він один займав об'єм, рівний об'ємові суміші при тій самій температурі.
Парціальний тиск окремої складової частини (компонента) суміші, якщо її можна вважати ідеальним газом, визначається за формулою:
{\displaystyle p_{i}=\nu _{i}{\frac {RT}{V}},}{\displaystyle p_{i}=\nu _{i}{\frac {RT}{V}},}
де {\displaystyle \nu _{i}}{\displaystyle \nu _{i}} — кількість речовини даної (і-тої) компоненти, R — газова стала, T і V — відповідно, температура та об'єм суміші.
Згідно із законом Дальтона у випадку ідеальних газів парціальні тиски окремих компонентів суміші газів сумуються
{\displaystyle p=\sum _{i}p_{i}\,.}{\displaystyle p=\sum _{i}p_{i}\,.}
Парціальний тиск кожного із компонентів пропорційний частці цього компонента в суміші газів.
{\displaystyle p_{i}=x_{i}p}{\displaystyle p_{i}=x_{i}p},
де
{\displaystyle x_{i}={\frac {\nu _{i}}{\nu }}}{\displaystyle x_{i}={\frac {\nu _{i}}{\nu }}},
{\displaystyle \nu _{i}}{\displaystyle \nu _{i}} — кількість речовини i-го газу в суміші, {\displaystyle \nu }\nu — загальна кількість речовини газу.