ΔT=100,1 К
Объяснение:
Первое начало термодинамики
Q=A+ΔU
Если считать, что общее количество тепла, полученное газом, за весь процесс равно 416 Дж, то
Q=Q12+Q23+Q34
рассмотрим
Q12=A12+ΔU12. A=pΔV, т.к. ΔV=0 ⇒ A=0 ⇒Q12=ΔU12=*v*R*ΔT
Q23=A12+ΔU12 Работа газом совершена отрицательная, и ΔT <0
Q23=-A12+-ΔU12=-pΔV-*v*R*ΔT
из ур Менделеева-Клапейрона
pΔV=v*R*ΔT, тогда
Q23=-A12+-ΔU12=-v*R*ΔT-*v*R*ΔT=- *v*R*ΔT
Q34=A34+ΔU34. A=pΔV, т.к. ΔV=0 ⇒ A=0 ⇒Q34=ΔU34=*v*R*ΔT
Q=Q12+Q23+Q34=*v*R*ΔT- *v*R*ΔT+*v*R*ΔT=v*R*ΔT*
Отсюда
ΔT=Q/(v*R* )
если газ одноатомный, то i=3, но про это в условии не сказано
ΔT=416/(1*8,31*0,5)=100,1 К
ΔT=100,1 К
Объяснение:
Первое начало термодинамики
Q=A+ΔU
Если считать, что общее количество тепла, полученное газом, за весь процесс равно 416 Дж, то
Q=Q12+Q23+Q34
рассмотрим
Q12=A12+ΔU12. A=pΔV, т.к. ΔV=0 ⇒ A=0 ⇒Q12=ΔU12=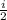 *v*R*ΔT
*v*R*ΔT
Q23=A12+ΔU12 Работа газом совершена отрицательная, и ΔT <0
Q23=-A12+-ΔU12=-pΔV-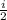 *v*R*ΔT
*v*R*ΔT
из ур Менделеева-Клапейрона
pΔV=v*R*ΔT, тогда
Q23=-A12+-ΔU12=-v*R*ΔT-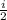 *v*R*ΔT=-
*v*R*ΔT=- 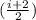 *v*R*ΔT
*v*R*ΔT
Q34=A34+ΔU34. A=pΔV, т.к. ΔV=0 ⇒ A=0 ⇒Q34=ΔU34=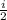 *v*R*ΔT
*v*R*ΔT
Q=Q12+Q23+Q34=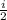 *v*R*ΔT-
*v*R*ΔT- 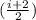 *v*R*ΔT+
*v*R*ΔT+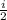 *v*R*ΔT=v*R*ΔT*
*v*R*ΔT=v*R*ΔT*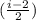
Отсюда
ΔT=Q/(v*R*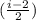 )
)
если газ одноатомный, то i=3, но про это в условии не сказано
ΔT=416/(1*8,31*0,5)=100,1 К