ответ: °С
Объяснение:
Дано:
°С
------------------
Пусть - теплоемкость калориметра
- теплоемкость воды в ложке
- начальная температура калориметра
- конечная температура калориметра
- температура воды в ложке
Теперь запишем уравнение теплового баланса после того как мы влили первую ложку воды в пустой калориметр
- уравнение (1)
Аналогично и для второго случая
- уравнение (2)
В уравнении (2) фигурирует так как это уже "вторая ложка"
Получаем систему из уравнений (1) и (2)
Разделим уравнение уравнение (1) на (2)
Подставляя численные значения упростим
Тогда подставляя это в уравнение в уравнение (1) получим
После вливания в калориметр третьей ложки получим что
Если то
Допустим °С
Тогда
V=13л=0,013
РО(плотность гелия) = 0,179 кг/
Решение:
При изохорном процессе - V и m - const.
Поэтому применим закон Шарля:
1)
2) Найдем массу 13л гелия:
m=плотность*объем=0,179*0,013=0,002327кг
3) Из уравнения состояния идеального газа найдем термодинамическую температуру гелия при давлении 148000Па и объеме 13л:
T=
4) По условиям задачи Гелий нагревали и его температура возросла в 4 раза, а значит первоначальная температура была 125/4=
5) Формула для нахождения количества теплоты: Q=cm(
Q=496500 Дж
ответ: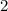 °С
°С
Объяснение:
Дано:
------------------
Пусть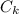 - теплоемкость калориметра
- теплоемкость калориметра
Теперь запишем уравнение теплового баланса после того как мы влили первую ложку воды в пустой калориметр
Аналогично и для второго случая
В уравнении (2) фигурирует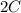 так как это уже "вторая ложка"
так как это уже "вторая ложка"
Получаем систему из уравнений (1) и (2)
Разделим уравнение уравнение (1) на (2)
Подставляя численные значения упростим
Тогда подставляя это в уравнение в уравнение (1) получим
После вливания в калориметр третьей ложки получим что
Если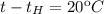 то
то 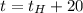
Допустим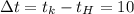 °С
°С
Тогда