Теперь найдем массу сульфида натрия. Зная, что его содержание в растворе равно 5%, умножим массу раствора на 5%: 140 г * 0,05 = 7 г
Найдем молярные массы сульфида натрия и сероводородной кислоты. Для этого из таблицы Менделеева выпишем атомные массы элементов, входящих в эти соединения: натрия, серы и водорода. Они равны 23, 32 и 1 соответственно. Затем сложим их, учитывая индексы: M Na₂S = 23*2 + 32 = 78 г/моль M H₂S = 1*2 + 32 = 34 г/моль
Зная массу сульфида натрия и его молярную массу, можем вычислить количество вещества: n = m/M n Na₂S = 7г / 78 г/моль = 0,09 моль n Na₂S = n H₂S
Один моль любого газа при нормальных условиях занимает объем, равный 22,4 л. По уравнению реакции, мы имеем один моль сероводорода, по условию задачи -- 0,09 моль. Составим пропорцию: 1 моль -- 22,4 л 0,09 моль -- х л х = 0,09 * 22,4 х = 2,01 ответ: 2,01 литра.
Na₂S + H₂SO₄ = Na₂SO₄ + H₂S↑
Теперь найдем массу сульфида натрия. Зная, что его содержание в растворе равно 5%, умножим массу раствора на 5%:
140 г * 0,05 = 7 г
Найдем молярные массы сульфида натрия и сероводородной кислоты. Для этого из таблицы Менделеева выпишем атомные массы элементов, входящих в эти соединения: натрия, серы и водорода. Они равны 23, 32 и 1 соответственно. Затем сложим их, учитывая индексы:
M Na₂S = 23*2 + 32 = 78 г/моль
M H₂S = 1*2 + 32 = 34 г/моль
Зная массу сульфида натрия и его молярную массу, можем вычислить количество вещества:
n = m/M
n Na₂S = 7г / 78 г/моль = 0,09 моль
n Na₂S = n H₂S
Один моль любого газа при нормальных условиях занимает объем, равный 22,4 л. По уравнению реакции, мы имеем один моль сероводорода, по условию задачи -- 0,09 моль. Составим пропорцию:
1 моль -- 22,4 л
0,09 моль -- х л
х = 0,09 * 22,4
х = 2,01
ответ: 2,01 литра.
KOH калій гідроксид
RbOH рубідій гідроксид
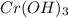 хром (ІІІ) гідроксид
хром (ІІІ) гідроксид
Примітка:Назви основ пиши з малої букви.