Дано:
ω(NH₄Cl) = 16%
ρ(р-ра NH₄Cl) = 1,148 гр/см³
----------------------------------------
Найти:
1) Для начала мы найдем массу раствора хлорида аммония:
Допустим у нас имеется 100 мл (100 см³ или 0,1 л) данного раствора, тогда:
m(р-ра NH₄Cl) = ρ(р-ра NH₄Cl) × V(р-ра NH₄Cl) = 1,148 гр/см³ × 100 см³ = 114,8 гр
2) Далее находим массу чистого вещества хлорида аммония по такой формуле:
m(NH₄Cl) = m(р-ра NH₄Cl) × ω(NH₄Cl)/100% = 114,8 гр × 16%/100% = 114,8 гр × 0,16 = 18,368 гр ≈ 18,37 гр
3) Далее находим молекулярную массу хлорида аммония:
M(NH₄Cl) = 14+1×4+35,5 = 14+4+35,5 = 53,5 гр/моль
4) Теперь находим количество вещества хлорида аммония:
n(NH₄Cl) = m(NH₄Cl)/M(NH₄Cl) = 18,37 гр / 53,5 гр/моль ≈ 0,34 моль
5) Теперь находим молярную концентрацию хлорида аммония:
= 0,34 моль / 0,1 л = 3,4 моль/л
ответ: моль/л
₁₆S²⁻ )₂ )₈ )₈ 1s²2s²2p⁶3s²3p⁶
Сера имеет заряд 2- , значит она приняла два электрона к уже своим имеющимся 16, в итоге сумма электронов стала - 18.
₁₈Ar )₂ )₈ )₈ 1s²2s²2p⁶3s²3p⁶
Аргон имеет устойчивое состояния, являясь благородным газов, в сумме электронов - 18.
₁₅P³⁻ )₂ )₈ )₈ 1s²2s²2p⁶3s²3p⁶
Фосфор имеет заряд 3- , значит он принял три электрона к уже своим имеющимся 15, в итоге сумма электронов стала - 18.
То есть все данные элементы имеют одинаковое количество электронов и являются изоэлектронными частицами.
Объяснение:
Дано:
ω(NH₄Cl) = 16%
ρ(р-ра NH₄Cl) = 1,148 гр/см³
----------------------------------------
Найти:
1) Для начала мы найдем массу раствора хлорида аммония:
Допустим у нас имеется 100 мл (100 см³ или 0,1 л) данного раствора, тогда:
m(р-ра NH₄Cl) = ρ(р-ра NH₄Cl) × V(р-ра NH₄Cl) = 1,148 гр/см³ × 100 см³ = 114,8 гр
2) Далее находим массу чистого вещества хлорида аммония по такой формуле:
m(NH₄Cl) = m(р-ра NH₄Cl) × ω(NH₄Cl)/100% = 114,8 гр × 16%/100% = 114,8 гр × 0,16 = 18,368 гр ≈ 18,37 гр
3) Далее находим молекулярную массу хлорида аммония:
M(NH₄Cl) = 14+1×4+35,5 = 14+4+35,5 = 53,5 гр/моль
4) Теперь находим количество вещества хлорида аммония:
n(NH₄Cl) = m(NH₄Cl)/M(NH₄Cl) = 18,37 гр / 53,5 гр/моль ≈ 0,34 моль
5) Теперь находим молярную концентрацию хлорида аммония:
ответ: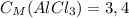 моль/л
моль/л
₁₆S²⁻ )₂ )₈ )₈ 1s²2s²2p⁶3s²3p⁶
Сера имеет заряд 2- , значит она приняла два электрона к уже своим имеющимся 16, в итоге сумма электронов стала - 18.
₁₈Ar )₂ )₈ )₈ 1s²2s²2p⁶3s²3p⁶
Аргон имеет устойчивое состояния, являясь благородным газов, в сумме электронов - 18.
₁₅P³⁻ )₂ )₈ )₈ 1s²2s²2p⁶3s²3p⁶
Фосфор имеет заряд 3- , значит он принял три электрона к уже своим имеющимся 15, в итоге сумма электронов стала - 18.
То есть все данные элементы имеют одинаковое количество электронов и являются изоэлектронными частицами.
Объяснение: