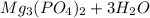1. Калий – элемент главной подгруппы I группы, хлор – элемент главной подгруппы VII группы. Укажите, сколько атомов калия и хлора образуют между собой ионную связь:
а) 1 атом калия и 1 атом хлора в) 1 атом калия и 2 атома хлора
б) 2 атома калия и 1 атом хлора г) 1 атом калия и 7 атомов хлора
2. Коэффициентом в записи 3Ca+2 Cl-2 является: а) -1 в б) 3 в) 2+ г) 2
3. Сера – это элемент главной подгруппы VI группы. Определите число неспаренных электронов на внешнем уровне:
а) три б) два в) пять г) восемь
4. Сколько ковалентных связей образуют между собой атомы брома в молекуле Br2:
а) восемь б) две в) три г) одну
5. Укажите, в какой молекуле длина ковалентных связей меньше:
а) азота б) брома в) серы г) кремния
6. Какой из элементов в молекуле сероводорода (Н2S) имеет наименьшую электроотрицательность:
а) водорода в) электроотрицательности атомов равны
б) сера г) электроотрицательности атомов равны нулю
7. В какой из молекул ковалентная химическая связь наименее полярна:
а) HCl б) HBr в) HI г) H2
8. Какую связь образуют между собой атомы в образце калия:
а) ковалентную полярную в) металлическую
б) ковалентную неполярную г) ионную
9. При образовании ковалентной связи обобществляются:
а) внешние непарные электроны соседних атомов
б) внешние непарные электроны всех атомов
в) все электроны атомов
г) ионы элементов
10. Атомы на внешнем уровне содержат разное число электронов, из которых один неспаренный. При образовании молекулы электрон одного атома передается другому атому. Что это за связь:
а) ковалентная полярная в) металлическая
б) ковалентная неполярная г) ионная
11. Определите тип химической связи для вещества нитрида лития (Li3N):
а) ковалентная полярная в) металлическая
б) ионная г) ковалентная неполярная
12. Частичный заряд (δ) образуется на атоме:
а) из-за смещения электронных пар б) из-за передачи электронов атомами
в) из-за обобществления внешних электронов г) из-за ионизации атомов
13. Укажите пункт, в котором перечислены молекулы веществ со всеми известными вам четырьмя видами связей – полярной и неполярной ковалентной, ионной и металлической:
а) Cl2, Na, Cl2O, NaCl б) HBr, Li, Cl2O, I2 в) K, KI, CaI2, H2S
г) HCl, Li, H2O, Cl2
14. Укажите пункт, в котором представлены не все из известных вам видов связей (полярная и неполярная ковалентная, ионная, металлическая):
а) F2, Na, H2S, CO2 б) HF, Li, Na2O, Br2 в) K, HF, I2 , H2S
г) OF2, Li, Na2O, Cl2O
15. Укажите пункт, в котором молекула одного из веществ обладает отличающимся от остальных видом связи:
а) F2, Na, H2, I2 б) HF, H2O, Cl2O, OF2 в) LiF, Na2O, KI, NaCl
г) OF2, Cl2O, HCl, Cl3N
16. Укажите пункт, в котором молекулы веществ обладают только ковалентной связью:
а) Cl2, Li , Br2 , I2 б) CuO, Na2O, Br2O, OF2 в) NaF, K2O, KI, NaCl
г) OF2, Cl2O, HCl, Cl3N
17. Как называется атомов данного химического элемента оттягивать к себе электроны от атомов других элементов в соединениях:
а) металличность б) валентность в) степень окисления
г) электроотрицательность
18. Пользуясь Периодической системой химических элементов, укажите, какой из перечисленных элементов имеет наибольшую электроотрицательность:
а) азот б) мышьяк в) селен г) кислород
19. Какое из перечисленных веществ не образует ионную кристаллическую решетку:
а) литий б) оксид лития в) гидрид лития г) гидроксид лития
20. Легкоплавкими обычно являются вещества, в узлах кристаллической решетки которых находятся:
а) атомы б) ионы в) молекулы г) атомы и ионы
памагити нормальный ответ
CxHyOz+ (x+y/2-z/2)O2= xCO2+ y/2H2O
1) m(C)=m(CO2)*w(C)=3.96*12/44=1.08
2) m(H)=m(H2O)*w(H)=0.54*2/18=0.06
3) m(O)=m(CxHyOz)-m(C)-m(H)=1.86-1.08-0.06=0.72
4)n(X)=m(X)/M(X)
1.08/12=0.09 0.06/1=0.06 0.72/16= 0.045
0.09/0.045=2 0.06/0.045 =1.3333 0.045/0.045=1
2*3 1.3333*3 1*3
6 4 3
C6H4O3
2. CxHyOz+ (x+y/2-z/2)O2= xCO2+ y/2H2O
1) m(C)=n(C)*M(C)=3.36/22.4*12=1.8
2) m(H)=m(H2O)*w(H)=3.6*2/18=0.4
3) m(O)=m(CxHyOz)-m(C)-m(H)=3-1.8-0.4=0.8
1.8/12=0.15 0.4/1=0.4 0.8/16=0.05
0.15/0.05=3 0.4/0.05=8 0.8/0.8=1
C3H8O=29*2.07=60
1. а)У калия б)У натрия (металлические свойства увеличиваются по периоды справа налево, а в группе сверху вниз )
2.Si - кремний
а)IVа группа 3 период
б)+14 Si )2)8)4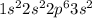
в)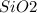 - кислотный, не растворяется в воде
- кислотный, не растворяется в воде
3.Металлические(восстановительные), основные свойства усиливаются слева направо (←), неметаллические(окислительные) и кислотные свойства усиливаются справа налево (→), также электроотрицательность усиливается справа налево (→), радиус атома увеличивается слева направо (←)
4. 12-Магний (Mg) 15-Фосфор (P)
MgO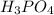
3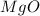 +2
+2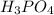 =
=