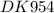1.Обчислити масову частку солі у розчині, утвореному з 60 г води і 4г солі
2. Яку масу цукру і води потрібно взяти для приготування 150г розчину з масовою часткою цукру 20%
3.яку маски соди треба розчинити в 200г води для отримання 5%-го розчину соди.
4. Яку масу води треба додати до 8%-го розчину алюміній хлорид, щоб отримати 300г 5%-го розчину алюміній хлориду.
5. До 500г розчину з масовою часткою солі 3% додали 10г солі. Обчіслити масову частку солі у розчині , що утворився
нас окружает кислород, то-есть то чем мы дышим, когда в природу поступает, мусор и отходы воздух загрязняется.
прежде всего я не мусорю , если оставлять мусор на земле то он очень долго будет разлагаться и это нанесёт огромный вред природе.
экономлю электроэнергию.
Я выключаю приборы после их использования и днем использую естественное освещение.
Я не использую полиэтиленовые пакеты, в них содержится, большое количество вредных веществ, клей и краска. полиэтиленовые пакеты разлагаются 400-700 лет, вместо этих пакетов, можно использовать один многоразовый тканевый пакет
Дано:
C = 4,3×10⁻³ моль/л
α = 0,1% = 0,001 = 10⁻³
Найти:
K(дисс.)₁(H₂CO₃) - ?
1) Для начала мы напишем уравнение диссоциаций у угольной кислоты, и потом из него составляем констант диссоциации угольной кислоты по первой ступени:
H₂CO₃ ⇄ H⁺ + HCO₃⁻ - 1-я ступень диссоциаций
K(дисс.)₁(H₂CO₃) = ([H⁺]×[HCO₃⁻])/[H₂CO₃] - констант диссоциации угольной кислоты по первой ступени
2) Степень диссоциации - обозначают его α, тогда [H⁺] = [HCO₃⁻] = Cα, и [H₂CO₃] = C(1-α). Подставим эти значения в констан диссоциаций и мы получим в итоге общую форуму для нахождения первой константы диссоциации угольной кислоты:
K(дисс.)₁(H₂CO₃) = ([H⁺]×[HCO₃⁻])/[H₂CO₃] = (Cα × Cα) / C(1-α) = C²α² / C(1-α) = Cα² / (1-α), следовательно мы получаем:
K(дисс.)₁(H₂CO₃) = Cα² / (1-α) = (4,3×10⁻³ моль/л × (10⁻³)²) / (1 - 0,001) = (4,3×10⁻³ моль/л × 10⁻⁶) / 0,999 = 4,3×10⁻⁹ моль/л / 0,999 ≈ 4,3×10⁻⁹ моль/л
ответ: K(дисс.)₁(H₂CO₃) = 4,3×10⁻⁹ моль/л
Решено от :