Перекись водорода - H2O2 V(H2O2)=m/M*Vмолярное m - масса, V объем, M-масса по таблице, Vмолярное - всегда 22,4 г/моль
V(H2O2)= 6000/34*22б4 = 3952,94 л n(H2O2)=m/M=176.47 моль n - кол-во молей данного вещества. N(H2O2)=N(a)*n(H2O2) N(H2O2)=6.02* * 176.47 = 1062,3494* N - число молекул/атомов всей перекиси, теперь ищем отдельно для каждого элемента W(H2)=2/34=6% W(O2)=94% m(H2)=360г m(O2)=5640г N(H2)= 6.02* * 360/2 = 1083,6*
N(O2)= 6.02* * 5640/32 = 1061,025*
Вот мы и получили ответы. Конечно они немного примерные, с такими числами почти невозможно норм работать.
1)CaCO3 + 2HCl = CaCl2 + H2O + CO2 Выделяется углекислый газ. Хотя на практике мрамор у вас не будет реагировать с соляной кислотой, слишком инертная форма. Мел - будет.
2) раствор известковый это гидроокись кальция при при продувании его даже воздухом в котором содержится углекислый газ происходит сначала образование карбоната кальция, нерастворимого в воде, а затем при еще большем насыщении СО2 образуются гидрокарбонаты растворимость которых выше.
Ca(OH)2 + CO2 = CaCO3 +H2O CaCO3 + 2H2CO3 = CaHCO3 + H2O + CO2
3) образуется угольная кислота CO2 + H2O = H2CO3
4)
CaCO3 + 2HCl => CaCl2 + H2O + CO2 CaCO3 + 2H(+) = Ca(+2) + H2O + CO2
Ca(OH)2 + CO2 => CaCO3 + H2O Ca(+2) + 2OH(-) + CO2 = CaCO3 + H2O
Перекись водорода - H2O2
V(H2O2)=m/M*Vмолярное m - масса, V объем, M-масса по таблице, Vмолярное - всегда 22,4 г/моль
V(H2O2)= 6000/34*22б4 = 3952,94 л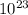 * 176.47 = 1062,3494*
* 176.47 = 1062,3494* 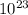
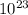 * 360/2 = 1083,6*
* 360/2 = 1083,6* 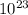
n(H2O2)=m/M=176.47 моль n - кол-во молей данного вещества.
N(H2O2)=N(a)*n(H2O2)
N(H2O2)=6.02*
N - число молекул/атомов всей перекиси, теперь ищем отдельно для каждого элемента
W(H2)=2/34=6%
W(O2)=94%
m(H2)=360г
m(O2)=5640г
N(H2)= 6.02*
N(O2)= 6.02*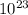 * 5640/32 = 1061,025*
* 5640/32 = 1061,025* 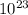
Вот мы и получили ответы. Конечно они немного примерные, с такими числами почти невозможно норм работать.
1)CaCO3 + 2HCl = CaCl2 + H2O + CO2
Выделяется углекислый газ. Хотя на практике мрамор у вас не будет реагировать с соляной кислотой, слишком инертная форма. Мел - будет.
2) раствор известковый это гидроокись кальция при при продувании его даже воздухом в котором содержится углекислый газ происходит сначала образование карбоната кальция, нерастворимого в воде, а затем при еще большем насыщении СО2 образуются гидрокарбонаты растворимость которых выше.
Ca(OH)2 + CO2 = CaCO3 +H2O
CaCO3 + 2H2CO3 = CaHCO3 + H2O + CO2
3) образуется угольная кислота
CO2 + H2O = H2CO3
4)
CaCO3 + 2HCl => CaCl2 + H2O + CO2
CaCO3 + 2H(+) = Ca(+2) + H2O + CO2
Ca(OH)2 + CO2 => CaCO3 + H2O
Ca(+2) + 2OH(-) + CO2 = CaCO3 + H2O
CaCO3+CO2 +H2O => Ca(HCO3)2
CaCO3 + CO2+H2O => Ca(+2) + 2HCO3(-)