1)вычислите массу этилового спирта если при его дегидратации получили 28 л этилена. условия нормальные. 2)определите массу галогеноводорода которая образуется при пропускании 16,8г пропилена через бромную воду.
кроме инертных газов неона и аргона , другие атомы химических элементов могут превращаться себя ионам. все атомы могут прикрепляв или потеряв электроны станут ионами. например: серебро на нитрате серебра или хлорида серебра
Объяснение:
инертные гази только они одноатомные гази. К инертным ным газам относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радиоактивный радон (Rn). Характеристики инертных газов объяснены современными теориями структуры атома: их электронные оболочки из валентных электронов являются заполненными, тем самым позволяя участвовать лишь в очень малом количестве химических реакций: известны всего несколько сотен химических соединений этих элементов. Наиболее «инертны» неон и гелий: чтобы заставить их вступить в реакцию,
с методов оптической спектроскопии и масс-спектрометрии установлено существование ионов Ne+, (NeAr)+, (NeH)+, и (HeNe)+.
кроме инертных газов неона и аргона , другие атомы химических элементов могут превращаться себя ионам. все атомы могут прикрепляв или потеряв электроны станут ионами. например: серебро на нитрате серебра или хлорида серебра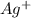
Объяснение:
инертные гази только они одноатомные гази. К инертным ным газам относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радиоактивный радон (Rn). Характеристики инертных газов объяснены современными теориями структуры атома: их электронные оболочки из валентных электронов являются заполненными, тем самым позволяя участвовать лишь в очень малом количестве химических реакций: известны всего несколько сотен химических соединений этих элементов. Наиболее «инертны» неон и гелий: чтобы заставить их вступить в реакцию,
с методов оптической спектроскопии и масс-спектрометрии установлено существование ионов Ne+, (NeAr)+, (NeH)+, и (HeNe)+.
Объяснение:
Дано:
m(P2O5)=71 г
m(H2O)-?
Запишемо рівняння реакції:
71 г x г
P2O5 + 3H2O = 2H3PO4
142 г 54 г
Знайдемо молярні маси речовин фосфор(V) оксиду та води:
Mr(Р2O5)=2*Ar(Р)+5*Ar(O)=2*31+5*16=142г/моль
маса 1 моль=142 г
Так як прореагувало 1 моль фосфор (V) оксиду P2O5 з 3 молями води H2O,то отримаємо
Mr(H2O)=2*Ar(H)+Ar(O)=2*1+16=18 г/моль
Маса 1 моль=18 г, а маса 3 моль = 54 г
Складемо пропорцію і обчислимо масу води.
71 / 142 = x / 54 звідси
х * 142 = 71 * 54
х * 142 = 3834
х =3834 : 142
х= 27
Витратилося 27 г води