3–58. Используя кривые растворимости, определите наименьшее количество воды, в которой: а) при температуре 45°С растворится 3,5 г нитрата свинца (2) Pb(NO³)²; б) при температуре 25С — 4 г хлорида бария BaCl², желательно,подробный и развернутый ответ
11,2 л х моль
1.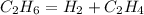
22,4 л 1 моль
1) Найдем количество вещества этилена:
при разложении 22,4 л этана образуется 1 моль этилена,а
при -- // -- 11,2 л________________х моль, откуда
х=11,2*1/22,4=0,5 моль
2) Найдем объем этилена:
V(C2H4)=Vm*v(C2H4)=22,4*0,5=11,2 л
150 000 л х г
2.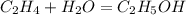
22,4 л 46 г
1.Найдем массу спирта,учитывая,что 150 кубометров- это 150 000 л:
при взаимодействии 22,4 л этилена образуется 46 г спирта, а
при -- // -- 150 000 л______________х г, откуда
х=150000*46/22,4=308036 г или 308 кг
Уравнение:
3Ca(NO3)2+2K3PO4=Ca3(PO4)2(осадок)+6KNO3
1. Находим массу вещ-ва нитрата кальция, вступившего в реакцию
масса вещ-ва Ca(NO3)2=массовая доля р-ра*массу р-ра/100=15*32,8/100=4,92г.
2.Судя по уравнению реакции, находим массы нитрата кальция и образовавшегося фосфата кальция
Молярная массаCa(NO3)2=164г/моль
Кол-во вещ-ва=3 моль
Масса=492г.
Молярная масса Ca3(PO4)2=310г/моль
Кол-во вещва=1 моль
Масса вещва=310г.
Т.е. судя по уравнению, при вступлении в реакцию 492г нирата сальция образовалось 310г. осадка фосфата кальция
А у нас 4,92г. нитрата кальция - даст х г. фосфата кальция
Решаем пропорцию и находим, что х=4,92*310/492=3,1г.
ответ: 3,1г. осадка фосфата кальция.