0 0 +1 -1
1)
0 +1
K -1e = K |2|восстановитель(окисление)
0 -1
Br2 + 2e = 2Br |1|окислитель(восстановление)
0 0 +2 -3
2)
0 +2
Ba - 2e = Ba |3|восстановитель(окисление)
0 -3
N2 + 6e = 2N |1|окислитель(восстановление)
0 +1 +2 0
3)
Mg -2e = Mg |1|восстановитель(окисление)
+1 0
2H +2e = H2 |1|окислитель(восстановление)
0 +1 +1 0
4)
Li - 1e = Li |2|восстановитель(окисление)
2H + 2e = H2 |1|окислитель(восстановление)
560 г х л
168 г 89,6 л
1. Сначала найдем теоретически возможный объем водорода,который может быть получен из такой массы железа:
при взаимодействии 168 г железа выделяется 89,6 л водорода, а
при -- // -- 560 г__________________х л, откуда
х=560*89,6/168=299 л
2. Отношение практического объема к теоретически возможному и есть выход продукта:
выход продукта=V факт./V теор.=200/299=0,67 или 67%
0 0 +1 -1
1)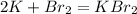
0 +1
K -1e = K |2|восстановитель(окисление)
0 -1
Br2 + 2e = 2Br |1|окислитель(восстановление)
0 0 +2 -3
2)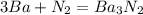
0 +2
Ba - 2e = Ba |3|восстановитель(окисление)
0 -3
N2 + 6e = 2N |1|окислитель(восстановление)
0 +1 +2 0
3)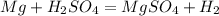
0 +2
Mg -2e = Mg |1|восстановитель(окисление)
+1 0
2H +2e = H2 |1|окислитель(восстановление)
0 +1 +1 0
4)
0 +1
Li - 1e = Li |2|восстановитель(окисление)
+1 0
2H + 2e = H2 |1|окислитель(восстановление)
560 г х л
168 г 89,6 л
1. Сначала найдем теоретически возможный объем водорода,который может быть получен из такой массы железа:
при взаимодействии 168 г железа выделяется 89,6 л водорода, а
при -- // -- 560 г__________________х л, откуда
х=560*89,6/168=299 л
2. Отношение практического объема к теоретически возможному и есть выход продукта:
выход продукта=V факт./V теор.=200/299=0,67 или 67%