1) Уравняем схему рекации:
Из чего можно сделать вывод о том, что KCl образуется столько же, сколько KClO3 было. А O2 в раза больше, поэтому.
моль
моль.
гг
2) 3 Ba + 2 H3PO4 → 3 H2 + Ba3(PO4)2
Бария столько же, сколько и водорода, следовательно
г
Фосфорной кислоты 3/4 от количества водорода
3) Поскольку 4,8% примесей, то
1000г*0,048=48 грамм примесей.
Тогда чистого железа
1000 - 48 = 952 г.
Fe+H2SO4 => FeSO4 + H2
n(Fe)=m/M=952/56=17 моль
Соли образуется столько же, сколько и железа было
n(Fe)=n(FeSO4)
m(FeSO4)=n*M = 17*152 = 2584 г
Водорода образуется столько же, поэтому
n(Fe)=n(H2)
V(H2)=n*Vm = 17* 22,4 = 380,8 л.
5s2 4d10 5p6 6s2 4f14 5d10 6p2
Короткая запись:
Pb: [Xe]6s2 4f14 5d10 6p2
Одинаковую электронную конфигурацию имеют атом свинца и Bi+1, Po+2, At+3
Порядок заполнения оболочек атома свинца (Pb) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ - до 6, на ‘d’ - до 10 и на ‘f’ до 14
Свинец имеет 82 электрона, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
2 электрона на 5s-подуровне
10 электронов на 4d-подуровне
6 электронов на 5p-подуровне
2 электрона на 6s-подуровне
14 электронов на 4f-подуровне
10 электронов на 5d-подуровне
2 электрона на 6p-подуровне
1) Уравняем схему рекации:
Из чего можно сделать вывод о том, что KCl образуется столько же, сколько KClO3 было. А O2 в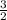 раза больше, поэтому.
раза больше, поэтому.
2) 3 Ba + 2 H3PO4 → 3 H2 + Ba3(PO4)2
Бария столько же, сколько и водорода, следовательно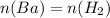
Фосфорной кислоты 3/4 от количества водорода
3) Поскольку 4,8% примесей, то
1000г*0,048=48 грамм примесей.
Тогда чистого железа
1000 - 48 = 952 г.
Fe+H2SO4 => FeSO4 + H2
n(Fe)=m/M=952/56=17 моль
Соли образуется столько же, сколько и железа было
n(Fe)=n(FeSO4)
m(FeSO4)=n*M = 17*152 = 2584 г
Водорода образуется столько же, поэтому
n(Fe)=n(H2)
V(H2)=n*Vm = 17* 22,4 = 380,8 л.
5s2 4d10 5p6 6s2 4f14 5d10 6p2
Короткая запись:
Pb: [Xe]6s2 4f14 5d10 6p2
Одинаковую электронную конфигурацию имеют атом свинца и Bi+1, Po+2, At+3
Порядок заполнения оболочек атома свинца (Pb) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ - до 6, на ‘d’ - до 10 и на ‘f’ до 14
Свинец имеет 82 электрона, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
2 электрона на 5s-подуровне
10 электронов на 4d-подуровне
6 электронов на 5p-подуровне
2 электрона на 6s-подуровне
14 электронов на 4f-подуровне
10 электронов на 5d-подуровне
2 электрона на 6p-подуровне