9. Сравните элементы, поставив знаки «>», «<» или «=». 1 • Заряд ядра . Радиус атома • Число энергетических уровней • Число электронов на внешнем уровне Na K So | N P As Sb .
Так, сначала я расскажу как я решал задачу, а потом оформление:
Сначала введем обозначения:
- масса раствора до добавления.
- масса раствора после добавления(соответственно)
- масса соли в первом растворе
- масса соли в получившемся растворе.
Исходное состояние.
Рассчитаем массу соли в исходном растворе.
= 0,15*350г = 52,5грамма.
Смешиваем.
Мы добавили к первоначальному растовру 20 грамм соли - значит мы увеличили массу раствора на 20грамм, т.е. масса получившегося раствора равна: г = 350г+20г = 370грамм
Но, добавив 20 грамм соли к раствору, мы увеличили не только массу арствора, но и массу соли которая есть в растворе, масса соли в получившемся растворе - грамм = 72,5 грамм.
Теперь у нас есть все, чтобы рассчитать массовую долю соли в получившемся растворе: = 72,5г/370г*100% = 19,6%
Теперь оформление:
Дано:
= 350г
масса добавленной соли = 20 грамм.
= 15%(или 0,15)
Найти:
= ?
Рассчитаем массу соли в растворе:
= 0,15*350г = 52,5г
Рассчитаем массу получившегося расвтора:
г = 350г + 20г = 370грамм
Рассчитаем массу соли в получившемся растворе: г = 52,5г + 20г = 72,5
HNO3 --> H(+) + NO3(-) H2SO4 I) H2SO4 --> H(+) + HSO4(-) II) HSO4(-) --> H(+) + SO4(-2) Общего - сильные электролиты, в растворе полностью диссоциируют на ионы. Различие - одна диссоциирует в одну ступень, другая в 2 ступени, так как двухосновная. На примере азотной кислоты трудно привести примеры свойств, потому что она обладает особыми свойствами. И продукты реакции у неё будут другими, чем у остальных кислот. Ну попробую, напишу общие с другими кислотами: 1) диссоциация - уравнение напишешь 2) с основными оксидами: CaO + 2HNO3 = Ca(NO3)2 + H2O - реакция обмена CaO + 2H(+) + 2NO3(-) = Ca(+2) + 2NO3(-) + H2O CaO + 2H(+) = Ca(+2) + H2O 3) c основаниями: Fe(OH)3 + 3HNO3 = Fe(NO3)3 + 3H2O - реакция обмена Fe(OH)3 + 3H(+) + 3NO3(-) = Fe(+3) + 3NO3(-) + 3H2O Fe(OH)3 + 3H(+) = Fe(+3) + 3H2O 4) c солями слабых и летучих кислот: Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O - реакция обмена 2Na(+) + CO3(-2) + 2H(+) + 2NO3(-) = 2Na(+) + 2NO3(-) + CO2 + H2O CO3(-2) + 2H(+) = CO2 + H2O
Так, сначала я расскажу как я решал задачу, а потом оформление:
Сначала введем обозначения:
Исходное состояние.
Рассчитаем массу соли в исходном растворе.
Смешиваем.
Мы добавили к первоначальному растовру 20 грамм соли - значит мы увеличили массу раствора на 20грамм, т.е. масса получившегося раствора равна: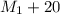 г = 350г+20г = 370грамм
г = 350г+20г = 370грамм
Но, добавив 20 грамм соли к раствору, мы увеличили не только массу арствора, но и массу соли которая есть в растворе, масса соли в получившемся растворе -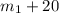 грамм = 72,5 грамм.
грамм = 72,5 грамм.
Теперь у нас есть все, чтобы рассчитать массовую долю соли в получившемся растворе:
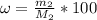 = 72,5г/370г*100% = 19,6%
= 72,5г/370г*100% = 19,6%
Теперь оформление:
Дано:
масса добавленной соли = 20 грамм.
Найти:
Рассчитаем массу соли в растворе:
Рассчитаем массу получившегося расвтора:
Рассчитаем массу соли в получившемся растворе:
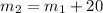 г = 52,5г + 20г = 72,5
г = 52,5г + 20г = 72,5
Рассчитываем массовую долю:
ответе: массовая доля соли = 19,6%(или0,196)
HNO3 --> H(+) + NO3(-)
H2SO4
I) H2SO4 --> H(+) + HSO4(-)
II) HSO4(-) --> H(+) + SO4(-2)
Общего - сильные электролиты, в растворе полностью диссоциируют на ионы.
Различие - одна диссоциирует в одну ступень, другая в 2 ступени, так как двухосновная.
На примере азотной кислоты трудно привести примеры свойств, потому что она обладает особыми свойствами. И продукты реакции у неё будут другими, чем у остальных кислот. Ну попробую, напишу общие с другими кислотами:
1) диссоциация - уравнение напишешь
2) с основными оксидами:
CaO + 2HNO3 = Ca(NO3)2 + H2O - реакция обмена
CaO + 2H(+) + 2NO3(-) = Ca(+2) + 2NO3(-) + H2O
CaO + 2H(+) = Ca(+2) + H2O
3) c основаниями:
Fe(OH)3 + 3HNO3 = Fe(NO3)3 + 3H2O - реакция обмена
Fe(OH)3 + 3H(+) + 3NO3(-) = Fe(+3) + 3NO3(-) + 3H2O
Fe(OH)3 + 3H(+) = Fe(+3) + 3H2O
4) c солями слабых и летучих кислот:
Na2CO3 + 2HNO3 = 2NaNO3 + CO2 + H2O - реакция обмена
2Na(+) + CO3(-2) + 2H(+) + 2NO3(-) = 2Na(+) + 2NO3(-) + CO2 + H2O
CO3(-2) + 2H(+) = CO2 + H2O
2)
Водный раствор хлорида аммония имеет кислую среду вследствие гидролиза:
NH4Cl + H2O = NH4OH + HCl
NH4(+) + Cl(-) + H2O = NH4(+) + OH(-) + H(+) + Cl(-)
H2O = H(+) + OH(-)