2NO2(г). Такие реакции называют 1)обратимые В обратимых реакциях 2) скорость прямой реакции вначале максимальная, а затем уменьшается из-за того, что 3)молярная концентрация исходных веществ. В момент, когда скорость прямой реакции равна скорости обратной наступает 4)химическое равновесие. Такое состояние сохраняется до тех пор, пока остаются неизменными условия реакции: 5)температура 6)давление, 7)концентрация. Как только условия изменяются, равновесие смещается в ту или иную сторону, т. е. химическое равновесие – динамический процесс.
Смещение химического равновесия подчиняется общему правилу, известному под названием принцип Ле Шателье и говорит оно следующее: увеличение температуры в системе ведет к смещению равновесия в сторону 8)эндотермической реакции; повышение давления приводит к смещению равновесия в сторону 9)меньшего объема; увеличении концентрации одного из исходных веществ приводит к смещению равновесия в сторону 10)продуктов реакции.
1) 3 атома водорода, 4 атома алюминия, 8 атомов магния, 1 молекула водорода, 1 молекула кислорода, 3 атома кислорода, 5 молекул метана, 4 молекулы углекислого газа, 1 молекула воды, 3 молекулы воды, 2 молекулы водорода, 3 атома азота, 4 молекулы азота
2)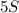 (5 атомов серы),
(5 атомов серы), 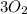 (3 молекулы кислорода),
(3 молекулы кислорода),  (4 атома меди),
(4 атома меди), 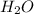 (1 молекула воды),
(1 молекула воды), 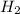 (2 атома водорода),
(2 атома водорода),  (1 молекула углекислого газа ), CO (молекула угарного газа),
(1 молекула углекислого газа ), CO (молекула угарного газа), 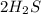 ( 2 молекулы сероводорода),
( 2 молекулы сероводорода), 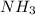 (молекула аммиака)
(молекула аммиака)
3)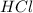 атом водорода и атом хлора
атом водорода и атом хлора
Mr (HCL) = Ar(H) + Ar (Cl) = 1 + 35, 5 = 36,5
Mr (H2S) = Ar(H) × 2 + Ar (S) = 2 + 32 = 34
Mr (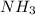 ) = Ar(N) + Ar (H) × 3 = 14 + 3 = 17
) = Ar(N) + Ar (H) × 3 = 14 + 3 = 17
Mr (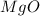 ) = Ar(Mg) + Ar (O) = 24 + 16 = 40
) = Ar(Mg) + Ar (O) = 24 + 16 = 40
Mr (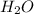 ) = Ar(H) × 2 + Ar (O) = 2 + 16 = 18
) = Ar(H) × 2 + Ar (O) = 2 + 16 = 18
Mr ( ) = Ar(C) + Ar (O) × 2 = 12 + 32 = 44
) = Ar(C) + Ar (O) × 2 = 12 + 32 = 44
Mr (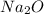 ) = Ar(Na) × 2 + Ar (O) = 46 + 16 = 62
) = Ar(Na) × 2 + Ar (O) = 46 + 16 = 62
Mr ( ) = Ar(S) + Ar (O) × 2 = 32 + 32 = 64
) = Ar(S) + Ar (O) × 2 = 32 + 32 = 64
4)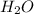 аш–два-о
аш–два-о
Mr (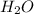 ) = Ar(H) × 2 + Ar (O) = 2 + 16 = 18
) = Ar(H) × 2 + Ar (O) = 2 + 16 = 18
Mr (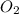 ) = Ar(O) × 2 = 32
) = Ar(O) × 2 = 32
Mr (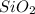 ) = Ar(Si) + Ar (O) × 2 = 28 + 32 = 60
) = Ar(Si) + Ar (O) × 2 = 28 + 32 = 60
Mr (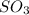 ) = Ar(S) + Ar (O) × 3 = 32 + 48 = 80
) = Ar(S) + Ar (O) × 3 = 32 + 48 = 80
Mr (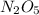 ) = Ar(N) × 2 + Ar (O) × 5 = 28 + 80 = 108
) = Ar(N) × 2 + Ar (O) × 5 = 28 + 80 = 108
Mr (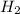 ) = Ar(H) × 2 = 2
) = Ar(H) × 2 = 2
Mr (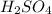 ) = Ar(H) × 2 + Ar (S) + Ar(O) × 4 = 2 + 32 + 64 = 98
) = Ar(H) × 2 + Ar (S) + Ar(O) × 4 = 2 + 32 + 64 = 98
Mr (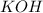 ) = Ar(K) + Ar (O) + Ar(H) = 39 + 16 + 1 = 56
) = Ar(K) + Ar (O) + Ar(H) = 39 + 16 + 1 = 56
Mr (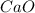 ) = Ar(Ca) + Ar (O) = 40 + 16 = 56
) = Ar(Ca) + Ar (O) = 40 + 16 = 56
Mr (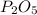 ) = Ar(P) × 2 + Ar (O) × 5 = 62 + 80 = 142
) = Ar(P) × 2 + Ar (O) × 5 = 62 + 80 = 142
Объяснение:
2NO2(г). Такие реакции называют 1)обратимые В обратимых реакциях 2) скорость прямой реакции вначале максимальная, а затем уменьшается из-за того, что 3)молярная концентрация исходных веществ. В момент, когда скорость прямой реакции равна скорости обратной наступает 4)химическое равновесие. Такое состояние сохраняется до тех пор, пока остаются неизменными условия реакции: 5)температура 6)давление, 7)концентрация. Как только условия изменяются, равновесие смещается в ту или иную сторону, т. е. химическое равновесие – динамический процесс.
Смещение химического равновесия подчиняется общему правилу, известному под названием принцип Ле Шателье и говорит оно следующее: увеличение температуры в системе ведет к смещению равновесия в сторону 8)эндотермической реакции; повышение давления приводит к смещению равновесия в сторону 9)меньшего объема; увеличении концентрации одного из исходных веществ приводит к смещению равновесия в сторону 10)продуктов реакции.