Дан раствор гидроксида кальция, а также набор следующих реактивов: газообразный оксид углерода(IV), водные растворы гидроксида натрия, фосфорной кислоты, нитрата бария и металлический цинк.
название:
формула:
класс:
Mr:
Используя только реактивы из приведённого перечня, запишите молекулярные уравнения возможных реакций, которые характеризуют химические свойства, укажите признаки их протекания, для одного напишите полное и краткое ионное уравнения.
Порядок заполнения электронами атомных орбиталей определяется:1.Принципом наименьшей энергии(картинка 1).
2. Состояние атома с полностью или наполовину заполненным подуровнем (т. е. когда на каждой орбитали имеется по одному неспаренному электрону) является более устойчивым.Этим объясняется «провал электрона. (картинка 2)
Атом хрома имеет электронную конфигурацию не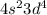 , a
, a 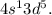 Это является примером того, как стабилизация состояний с параллельными спинами электронов преобладает над незначительной разницей энергетических состояний подуровней
Это является примером того, как стабилизация состояний с параллельными спинами электронов преобладает над незначительной разницей энергетических состояний подуровней 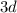 и
и 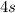 (правила Гунда), то есть энергетически выгодными состояниями для d-подуровня являются
(правила Гунда), то есть энергетически выгодными состояниями для d-подуровня являются 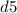 и
и 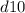 .
.
Подобный переход одного электрона с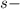 подуровня на
подуровня на 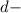 подуровень происходит еще у 8 элементов: Cu, Nb, Mo, Ru, Ag, Pt, Au. У атома Pd происходит переход двух
подуровень происходит еще у 8 элементов: Cu, Nb, Mo, Ru, Ag, Pt, Au. У атома Pd происходит переход двух 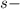 электронов на
электронов на 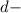 подуровень: Pd:
подуровень: Pd: 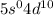 .
.
1) Определяем массу растворенного вещества (в граммах) в исходном растворе по формуле:
М(KCl) = ω * m(p-p)
где: ω - массовая доля растворенного вещества, выраженная в долях единицы
m(p-p) - масса раствора в граммах.
М(KCl) = 0,05 * 140 = 7г
2) После добавления воды ( а 110 мл воды = 110 г воды, т.к. плотность воды 1 г/мл) масса раствора стала: 140 + 110 = 250 г, а масса растворенного вещества осталась неизменной, то есть 7 г.
Тогда массовая доля растворенного вещества стала:
ω = М(KCl) / m(p-p) = 7 / 250 = 0,028 (или 2,8%)
ответ: 2,8%