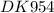1.какое из указанных веществ имеет металлическую связь? 3) bе 2.веществом с ковалентной неполярной связью является 1) бром 3.ковалентная полярная связь характерна для 1) h2s 4.ионная связь не характерна для соединения, образованного атомами 4) водорода и хлора 5.ионная связь не характерна для соединения, образованного атомами 4) водорода и хлора 6.такой же вид связи, как и в молекуле hbr, характерен для 1) pcl3 7.веществами с ковалентной полярной и ионной связью являются, соответственно, 4) вода и фторид магния 8.ковалентная полярная связь характерна для 2) hi 9.ковалентная неполярная связь характерна для 4) хлора 10.веществом с ионной связью является 2) бромид кальция 11.такой же вид связи, как и в молекуле h2s, характерен для 1) sio2 12.веществом с ковалентной полярной связью является 2) pcl3 13.одинаковый вид связи имеют 4) cao и libr 14.в молекуле аммиака связь 2) ковалентная полярная 15.веществами с ковалентной неполярной и металлической связью являются соответственно 4) n2 и pb
1) Для начала мы запишем уравнение реакций растворов то что известно в условий задачи:
Ba(NO₃)₂ + K₂CrO₄ → BaCrO₄↓ + 2KNO₃
2) Далее мы напишем формулу про произведение реакций у осадка, а потом находим в таблице осадка который образовался, при него мы определим будет ли этот осадок в перенасыщенном растворе:
BaCrO₄ → Ba²⁺ + CrO₄²⁻
ПР = [Ba²⁺]×[CrO₄²⁻] ПР(BaCrO₄) = 1,17×10⁻¹⁰ (в таблице)
3) При смешении равных объемов растворов Ba(NO₃)₂ и K₂CrO₄ объем смеси увеличивается в 2 раза, а концентрация каждого из ионов уменьшается в 2 раза. Следовательно:
[Ba²⁺] = 1/2 × Cm(Ba(NO₃)₂) = 1/2 × 0,001 М = 0,0005 М
[CrO₄²⁻] = 1/2 × Cm(K₂CrO₄) = 1/2 × 0,01 М = 0,005 М
4) Далее находим произведение реакций у осадка в полученных концентрациях и потом сравниваем произведение реакций осадок в таблице:
1) Для начала мы запишем уравнение реакций растворов то что известно в условий задачи:
Ba(NO₃)₂ + K₂CrO₄ → BaCrO₄↓ + 2KNO₃
2) Далее мы напишем формулу про произведение реакций у осадка, а потом находим в таблице осадка который образовался, при него мы определим будет ли этот осадок в перенасыщенном растворе:
BaCrO₄ → Ba²⁺ + CrO₄²⁻
ПР = [Ba²⁺]×[CrO₄²⁻] ПР(BaCrO₄) = 1,17×10⁻¹⁰ (в таблице)
3) При смешении равных объемов растворов Ba(NO₃)₂ и K₂CrO₄ объем смеси увеличивается в 2 раза, а концентрация каждого из ионов уменьшается в 2 раза. Следовательно:
[Ba²⁺] = 1/2 × Cm(Ba(NO₃)₂) = 1/2 × 0,001 М = 0,0005 М
[CrO₄²⁻] = 1/2 × Cm(K₂CrO₄) = 1/2 × 0,01 М = 0,005 М
4) Далее находим произведение реакций у осадка в полученных концентрациях и потом сравниваем произведение реакций осадок в таблице:
ПР = [Ba²⁺]×[CrO₄²⁻] = 0,0005 × 0,005 = 0,0000025 = 2,5×10⁻⁶
Следовательно:
ПР > ПР(BaCrO₄) = 2,5×10⁻⁶ > 1,17×10⁻¹⁰ ⇒ осадок будет образовываться
ответ: Осадок будет образовываться
Решено от :