Для следующих солей: фторид натрия, хлорид железа2, нитрат серебра, сульфид меди2, сульфат калия, карбонат магния, бромид цинка,иодид алюминия, сульфат марганца2, орто фосфат натрия. Написать химическую формулу соли и продукт электролиза на катоде и аноде для каждой соли.
Объяснение:
молярная масса эквивалента соли образующейся при взаимодействии 2 моль оксида углерода 4 степени с одним молем гидроксида магния равна?
Mg(OH)2 + 2CO2 → Mg(HCO3)2
гидрокарбонат магния
Чтобы рассчитать молярную массу эквивалента соли необходимо
величину молярной массы разделить на валентность металла с учетом числа атомов металла в составе соли:
Молярная масса Mg(HCO3)2 равна 146 г/моль
Тогда молярная масса эквивалента равна 146:2 = 73 г/моль
Дано:
Fe + FeO
HCl
m(FeCl2)=127 г
V(H2) = 13,44 л
Найти: m(FeO)-?
Запишем 2 уравнения и подпишем объем водорода в первой реакции, так как он образуется только в одной реакции
х г 13,44 л
1) Fe + 2HCl = FeCl2 + H2↑
127 г 22,4 л
(127-х)г
2) FeO + 2HCl = FeCl2 + H2O
Пусть, масса FeCl2 в первой реакции равна х г. Тогда, масса FeCl2 во второй реакции равна (127 - х) г. Подпишем это
Найдем массу FeCl2 в первой реакции
m1(FeCl2) =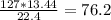 г
г
Если масса FeCl2 в первой реакции 76.2 г , то масса FeCl2 во второй реакции = 127 - 76,2 = 50,8 г
Перепишем еще раз вторую реакцию и подпишем массу FeCl2
у г 50,8 г
FeO + 2HCl = FeCl2 + H2O
72 г 127 г
Найдем массу оксида железа(II)
m(FeO) =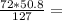 28.8 г
28.8 г
ответ: m(FeO)=28.8 г