ест по химии 9 класс итоговая

библиотека
материалов
Химия 9 , итоговая работа, вариант-1
Электронная конфигурация 2е- 8е- 5е-характерна для атома
K
N
Al
P
Аллотропные модификации НЕобразует
Азот
Фосфор
Кислород
Сера
Природные соединения серы
Кремнезем и каолинит
Гематит и лимонит
Гипс и глауберова соль
Мел и мрамор
Оксид углерода (IV) НЕ реагирует с
Mg
Ca(OH)2
SO3
CaO
Какая соль имеет щелочную среду
NaCl
Na2SO4
Na2SiO3
NaNO3
В какой реакции выпадает белый осадок
K2SO4 + BaCl2
K2CO3 + HNO3
CaCl2 + NaNO3
H3PO4 + AgNO3
C водой без нагревания реагирует
Цинк
Углерод
Натрий
Только окислителем может быть азот в соединении
HNO3
NaNO2
NO
NH3
И с гидроксидом натрия и с соляной кислотой реагирует
Al2O3
Na2O
Железо из Fe2O3 можно восстановить при
С
H2SO4
O2
H2О
Обратимой является реакция
Горение угля
Горение магния
Взаимодействие азота и водорода
Взаимодействие кальция с водой
Формула предельного углеводорода
C2H4
C2H6
C2H2
C6H6
Напишите уравнения реакций при которых можно осуществить следующие превращения
Si SiO2 Na2SiO3 H2SiO3
Вычислите объем углекислого газа (н. у.), которыйвыделится при взаимодействии 10 г мела с избытком серной кислоты.
Объяснение:
Окислитель и восстановитель определяются в реакции, а не в чистом веществе.
Возьмем на пример реакцию разложения твоего вещества CrO3.
Теперь надо расставить степени окисления каждого элемента:
Теперь мы можем видеть как изменились степени окисления.
Если элемент принимает электроны то он окислитель, а процесс восстановления. Степень окисления уменьшается.
Если элемент отдает электроны то восстановитель, а процесс окисления. Степень окисления увеличивается.
Теперь рассмотрим как поменялись степени окисления:
Как можем видеть окислитель, а восстановитель
ест по химии 9 класс итоговая

библиотека
материалов
Химия 9 , итоговая работа, вариант-1
Электронная конфигурация 2е- 8е- 5е-характерна для атома
K
N
Al
P
Аллотропные модификации НЕобразует
Азот
Фосфор
Кислород
Сера
Природные соединения серы
Кремнезем и каолинит
Гематит и лимонит
Гипс и глауберова соль
Мел и мрамор
Оксид углерода (IV) НЕ реагирует с
Mg
Ca(OH)2
SO3
CaO
Какая соль имеет щелочную среду
NaCl
Na2SO4
Na2SiO3
NaNO3
В какой реакции выпадает белый осадок
K2SO4 + BaCl2
K2CO3 + HNO3
CaCl2 + NaNO3
H3PO4 + AgNO3
C водой без нагревания реагирует
Цинк
Углерод
Натрий
Сера
Только окислителем может быть азот в соединении
HNO3
NaNO2
NO
NH3
И с гидроксидом натрия и с соляной кислотой реагирует
Al2O3
SO3
Na2O
Ca(OH)2
Железо из Fe2O3 можно восстановить при
С
H2SO4
O2
H2О
Обратимой является реакция
Горение угля
Горение магния
Взаимодействие азота и водорода
Взаимодействие кальция с водой
Формула предельного углеводорода
C2H4
C2H6
C2H2
C6H6
Напишите уравнения реакций при которых можно осуществить следующие превращения
Si SiO2 Na2SiO3 H2SiO3
Вычислите объем углекислого газа (н. у.), которыйвыделится при взаимодействии 10 г мела с избытком серной кислоты.
Объяснение:
Окислитель и восстановитель определяются в реакции, а не в чистом веществе.
Возьмем на пример реакцию разложения твоего вещества CrO3.
Теперь надо расставить степени окисления каждого элемента:
Теперь мы можем видеть как изменились степени окисления.
Если элемент принимает электроны то он окислитель, а процесс восстановления. Степень окисления уменьшается.
Если элемент отдает электроны то восстановитель, а процесс окисления. Степень окисления увеличивается.
Теперь рассмотрим как поменялись степени окисления:
Как можем видеть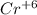 окислитель, а
окислитель, а 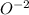 восстановитель
восстановитель