Газообразный продукт обжига сульфида марганца (II) окислили перманганатом калия в нейтральной среде .Полученная кислота в концентрированном виде прореагировала с цинком .Выделившийся газ окислили перманганатом калия, образовались два осадка , один из них желтого цвета .Напишите уравнения описанных реакций.
1) Найдем количество выделившегося газа:
n(NO2) = V/Vm = 8,96/22,4 = 0,4 моль
2) Из уравнения протекающей реакции видно, что n(Cu) = 0,5n(NO2) = 0,5*0,4 = 0,2 моль
3) Найдем массу меди:
m(Cu) = n*M = 0,2 * 64 =12,8г
4) Найдем массу алюминия в смеси:
m(Al) = m(смеси) - m(Cu) = 25-12,8 = 12,2г
5) Найдем массовые доли металлов в исходной смеси:
а) w(Al) = m(Al)*100/m(смеси) = 12,2*100 / 25 = 48,8%
б) w(Cu) = m(Cu)*100/m(смеси) = 12,8*100/25 = 51,2%
ответ: w(Cu) = 51,2% ;
w(Al) =48,8%.
Так, сначала я расскажу как я решал задачу, а потом оформление:
Сначала введем обозначения:
Исходное состояние.
Рассчитаем массу соли в исходном растворе.
Смешиваем.
Мы добавили к первоначальному растовру 20 грамм соли - значит мы увеличили массу раствора на 20грамм, т.е. масса получившегося раствора равна: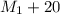 г = 350г+20г = 370грамм
г = 350г+20г = 370грамм
Но, добавив 20 грамм соли к раствору, мы увеличили не только массу арствора, но и массу соли которая есть в растворе, масса соли в получившемся растворе -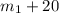 грамм = 72,5 грамм.
грамм = 72,5 грамм.
Теперь у нас есть все, чтобы рассчитать массовую долю соли в получившемся растворе:
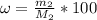 = 72,5г/370г*100% = 19,6%
= 72,5г/370г*100% = 19,6%
Теперь оформление:
Дано:
масса добавленной соли = 20 грамм.
Найти:
Рассчитаем массу соли в растворе:
Рассчитаем массу получившегося расвтора:
Рассчитаем массу соли в получившемся растворе:
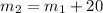 г = 52,5г + 20г = 72,5
г = 52,5г + 20г = 72,5
Рассчитываем массовую долю:
ответе: массовая доля соли = 19,6%(или0,196)