Химические свойства кислот в свете ТЭД
А) взаимодействие с основаниями –гидроксидами металлов
Б) с оксидами металлов-с основными оксидами
В) с солями
Г) с металлами
Для каждого пункта написать молекулярные, полные и сокращенные ионные уравнения. Указать (знать) условия протекания этих реакций (правила)
1. На внешнем уровне атомы щелочноземельных металлов имеют три электрона. Неверно. На внешнем уровне атомы щелочноземельных металлов находятся 2 электрона. Конфигурация внешнего уровня атомов щелочноземельных металлов -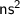 (где
(где  - номер периода, в котором находится элемент, или номер последнего энергетического уровня).
- номер периода, в котором находится элемент, или номер последнего энергетического уровня).
2. Щелочноземельные металлы реагируют с водой с выделением кислорода. Неверно. При взаимодействии щелочноземельных металлов с водой выделятся газ водород -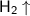 . Схема реакции взаимодействии щелочноземельных металлов с водой -
. Схема реакции взаимодействии щелочноземельных металлов с водой - 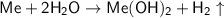 (где
(где 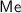 - щелочноземельный металл).
- щелочноземельный металл).
3. Щелочноземельные металлы активно реагируют с водой. Верно.
4. Стронций не может проводить тепло. Неверно. Стронций -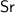 является металлом, а металлы могут проводить тепло.
является металлом, а металлы могут проводить тепло.
ответ : верное утверждение под номером 3.Признак реакции - выделение прозрачного газа, ионного уравнения тут нет, потому что оксид в уравнении.
2) Сu+ O2 = CuO
Fe + S = FeS
Cu+ HCl = CuCl + H2
3) 2K(0) + Cl2(0) = 2K(+1)Cl(-1)
2|К(0) -1е = К(+1) |окисление|восстановитель|
1|2Сl + 2e = Cl2(-1) |восстановление|окислитель|
4) Мел - это известняк, а известняк - это карбонат кальция. Формула карбоната кальция - СаСО3. СаСО3 раскладывается на ионы - катионы и анионы, чего органические вещества не делают. Следовательно, мел не является органическим веществом.