2. Если процесс происходит при нагревании, то появляется ярко-оранжевое окрашивание - оксид меди. C6H12O6 + 2Cu(OH)2(t) = C6H12O7 + Cu2O + 2H2O
в пробирке с глицерином с гидроксидом меди образуется темно-синий раствор - во вложении
3. На белок биуретова проба - во вложении реакция
Если к формальдегиду добавить щелочь и сульфат меди, а потом слегка подогреть появится оранжевый осадок оксида одновалентной меди. CuSO4 + 2NaOH ---> Cu(OH)2 + Na2SO4 R-CHO + 2Cu(OH)2 (t) ---> R-COOH + Cu2O + 2H2O
4. Растительные масла это эфиры глицерина и жирных непредельных кислот, поэтому они легко омыляются щелочью, при температуре 250 С и выше разлагаются на акролеин и жирные кислоты с неприятным запахом. Минеральные масла в основном состоят из предельных углеводородов С18Н38 и выше. Они не омыляются щелочами и не разлагаются при температуре.
5. Реакция на крахмал - с йодом дает синее окрашивание. 6. Описаны реакции 7. Сахароза не дает реакций серебряного зеркала и с гидроксидом меди в отличие от глюкозы
1. Запах альдегида:
C2H5OH =CuO= Cu + CH3COH + H2O
Реакция серебрянного зеркала
HCOOH + 2[Ag(NH3)2]OH = 2Ag + CO2 + 2H2O + 4NH3
2. Если процесс происходит при нагревании, то появляется ярко-оранжевое окрашивание - оксид меди.
C6H12O6 + 2Cu(OH)2(t) = C6H12O7 + Cu2O + 2H2O
в пробирке с глицерином с гидроксидом меди образуется темно-синий раствор - во вложении
3. На белок биуретова проба - во вложении реакция
Если к формальдегиду добавить щелочь и сульфат меди, а потом слегка подогреть появится оранжевый осадок оксида одновалентной меди.
CuSO4 + 2NaOH ---> Cu(OH)2 + Na2SO4
R-CHO + 2Cu(OH)2 (t) ---> R-COOH + Cu2O + 2H2O
4. Растительные масла это эфиры глицерина и жирных непредельных кислот, поэтому они легко омыляются щелочью, при температуре 250 С и выше разлагаются на акролеин и жирные кислоты с неприятным запахом.
Минеральные масла в основном состоят из предельных углеводородов С18Н38 и выше. Они не омыляются щелочами и не разлагаются при температуре.
5. Реакция на крахмал - с йодом дает синее окрашивание.
6. Описаны реакции
7. Сахароза не дает реакций серебряного зеркала и с гидроксидом меди в отличие от глюкозы
0,88 г 4,32 г
х г 216 г
1. Сначала найдем чистую массу альдегида в растворе:
m(CxHy)=w(CxHy)*m(раствора)=0,22*4=0,88 г
2. Подставив в уравнение эту массу получим относительную молекулярную массу вещества:
при взаимодействии 0,88 г альдегида выпадает 4,32 г осадка, а
при -- // -- // -- х г______________________216 г, откуда
х=0,88*216/4,32=44 г
3. Теперь подставив в формулу определения относительной массы,получим уравнение:
Значит формула альдегида: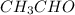 -уксусный альдегид
-уксусный альдегид