ответ: 8 г, 12 г, 11 г
Объяснение:
Для всех задач (а,б,в)
1) Находим кол-во вещества (оно будет одинаковым во всех задачах) по формуле: n=V/Vm
n=5.6 л/22,4 л/моль = 0,25 моль
2) Находим молярную массу (M)
3) Находим массу в-ва по формуле: m=n*M
А)
Дано:
V(O₂) = 5,6 л
Найти:
m(O₂)-?
1) n(O₂) = 0,25 моль
2) М(О₂) = 32 г/моль
3) m(O₂) = 0,25 моль*32 г/моль = 8 г
ответ: 8 г
Б)
V(O₃) = 5,6 л
m(O₃)-?
1) n(O₃) = 0,25 моль
2) М(О₃) = 48 г/моль
3) m(O₃) = 0,25 моль*48 г/моль = 12 г
ответ: 12 г
В)
V(СO₂) = 5,6 л
m(СO₂)-?
1) n(СO₂) = 0,25 моль
2) М(СО₂) = 44 г/моль
3) m(СO₂) = 0,25 моль*44 г/моль = 11 г
ответ: 11 г
пиши сам/сама
m(р-ра)=m(р-раBaCl2)+m(р-раH2SO4) = 50+50=100 гр
Запишем уравнение реакции: .
Рассчитаем m и n(BaCl2)и (H2SO4):
m(BaCl2)=50*0.05=2.5гр
n(BaCl2)=2.5/208=0.012моль
m(H2SO4)=50*0.05=2.5гр
n(H2SO4)=2.5/98=0.0255моль
Соответственно BaCl2 находится в недостатке, по нему и считаем.
В фильтрате находится избыток серной кислоты и получившаяся соляная.
Рассчитаем их массу.
H2SO4: так как из 0,0255 моль прореагировало только 0,012, избыток составил 0,0135 моль. Рассчитаем его массу: 0,0135*98=1,323гр
HCl: n(HCl) = 2*n(BaCl2)=2*0.012=0.024гр.
Рассчитаем массу осадка BaSO4: 0.012*233=2.796гр
Масса раствора без осадка = 100-2,796=97,204гр
W(HCl)=0,024/97,204=0,0247%
W(H2SO4изб)=1,323/97,204=1,36%
ответ: 8 г, 12 г, 11 г
Объяснение:
Для всех задач (а,б,в)
1) Находим кол-во вещества (оно будет одинаковым во всех задачах) по формуле: n=V/Vm
n=5.6 л/22,4 л/моль = 0,25 моль
2) Находим молярную массу (M)
3) Находим массу в-ва по формуле: m=n*M
А)
Дано:
V(O₂) = 5,6 л
Найти:
m(O₂)-?
1) n(O₂) = 0,25 моль
2) М(О₂) = 32 г/моль
3) m(O₂) = 0,25 моль*32 г/моль = 8 г
ответ: 8 г
Б)
Дано:
V(O₃) = 5,6 л
Найти:
m(O₃)-?
1) n(O₃) = 0,25 моль
2) М(О₃) = 48 г/моль
3) m(O₃) = 0,25 моль*48 г/моль = 12 г
ответ: 12 г
В)
Дано:
V(СO₂) = 5,6 л
Найти:
m(СO₂)-?
1) n(СO₂) = 0,25 моль
2) М(СО₂) = 44 г/моль
3) m(СO₂) = 0,25 моль*44 г/моль = 11 г
ответ: 11 г
Объяснение:
пиши сам/сама
m(р-ра)=m(р-раBaCl2)+m(р-раH2SO4) = 50+50=100 гр
Запишем уравнение реакции: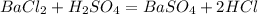 .
.
Рассчитаем m и n(BaCl2)и (H2SO4):
m(BaCl2)=50*0.05=2.5гр
n(BaCl2)=2.5/208=0.012моль
m(H2SO4)=50*0.05=2.5гр
n(H2SO4)=2.5/98=0.0255моль
Соответственно BaCl2 находится в недостатке, по нему и считаем.
В фильтрате находится избыток серной кислоты и получившаяся соляная.
Рассчитаем их массу.
H2SO4: так как из 0,0255 моль прореагировало только 0,012, избыток составил 0,0135 моль. Рассчитаем его массу: 0,0135*98=1,323гр
HCl: n(HCl) = 2*n(BaCl2)=2*0.012=0.024гр.
Рассчитаем массу осадка BaSO4: 0.012*233=2.796гр
Масса раствора без осадка = 100-2,796=97,204гр
W(HCl)=0,024/97,204=0,0247%
W(H2SO4изб)=1,323/97,204=1,36%