Какая масса меди соединится с 6,4 г серы, если количества атомов элементов в образовавшемся веществе относятся как 1:1? Точность вычислений — до десятых.
При плавлении солей карбоновых кислот со щелочами образуются сответственные предельные углеводороды,поэтому выйдет такое уравнение:
4,8 г 3,6 г
40 г х г
1. Найдем молекулярную массу углеводорода:
при взаимодействии 4,8 г гидроксида образуется 3,6 г углеводорода, а
при --//--//-- 40 г___________________х г, откуда
х=40*3,6/4,8=30 г
2. Зная общую формулу предельных углеводородов и подставив эту массу(цифру) в формулу по вычислению относительной молекулярной массы,получим уравнение:,значит формула углеводорода: - это этан
Углерод и кислород связаны ковалентными полярными связями: О=С=О. Т.к. молекула имеет линейное строение, то она неполярна.
Физ. св-ва: СО2 бесцветен, не имеет запаха, тяжелее воздуха, плохо растворяется в воде.
Он образуется при:
а) горении углерода в избытке кислорода:
С + О2 = СО2 (условия - температура)
б) разложении карбонатов и гидрокарбонатов при нагревании:
СаСО3 = СаО + СО2 (условия - температура)
2NaHCO3 = Na2CO3 + CO2 + H2O (условия - температура)
СО2 не поддерживает горения. Только некоторые активные металлы горят в нем, т.к отнимают кислород:
2Mg + CO2 = 2MgO + C
CО2 - кислотный оксид. Реагирует с снованиями, основными оксидами, с водой. При взаимодействии с водой образуется угольная к-та.
2) Св-ва кислот:
1) Диссоциация в водном растворе
2) + основание с образованием соли и воды (р-я нейтрализации)
3) + основный оксид с образованием соли и воды
4) + амфотерный оксид с образованием соли и воды
5) + амфотерный гидроксид
6) + нормальная соль с образованием новой соли и новой к-ты. Реакции возможны, если в их результате образуется нерастворимая соль или более слабая к-та, чем исходная. 7) + металл (харак ер взаимодействия зависит от самой кислоты)
При плавлении солей карбоновых кислот со щелочами образуются сответственные предельные углеводороды,поэтому выйдет такое уравнение:
4,8 г 3,6 г
40 г х г
1. Найдем молекулярную массу углеводорода:
при взаимодействии 4,8 г гидроксида образуется 3,6 г углеводорода, а
при --//--//-- 40 г___________________х г, откуда
х=40*3,6/4,8=30 г
2. Зная общую формулу предельных углеводородов и подставив эту массу(цифру) в формулу по вычислению относительной молекулярной массы,получим уравнение: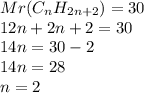 ,значит формула углеводорода:
,значит формула углеводорода: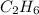 - это этан
- это этан
1) СО2
Углерод и кислород связаны ковалентными полярными связями: О=С=О. Т.к. молекула имеет линейное строение, то она неполярна.
Физ. св-ва: СО2 бесцветен, не имеет запаха, тяжелее воздуха, плохо растворяется в воде.
Он образуется при:
а) горении углерода в избытке кислорода:
С + О2 = СО2 (условия - температура)
б) разложении карбонатов и гидрокарбонатов при нагревании:
СаСО3 = СаО + СО2 (условия - температура)
2NaHCO3 = Na2CO3 + CO2 + H2O (условия - температура)
СО2 не поддерживает горения. Только некоторые активные металлы горят в нем, т.к отнимают кислород:
2Mg + CO2 = 2MgO + C
CО2 - кислотный оксид. Реагирует с снованиями, основными оксидами, с водой. При взаимодействии с водой образуется угольная к-та.
2) Св-ва кислот:
1) Диссоциация в водном растворе
2) + основание с образованием соли и воды (р-я нейтрализации)
3) + основный оксид с образованием соли и воды
4) + амфотерный оксид с образованием соли и воды
5) + амфотерный гидроксид
6) + нормальная соль с образованием новой соли и новой к-ты. Реакции возможны, если в их результате образуется нерастворимая соль или более слабая к-та, чем исходная.
7) + металл (харак ер взаимодействия зависит от самой кислоты)