Дано: m(SO₃) = 20 грамм, η(NaOH) = 12 % – концентрация раствора.
Уравнение реакции: SO₃ + 2NaOH → Na₂SO₄ + H₂O
молярная масса SO₃: М(SO₃) = 32 + 3·16= 32 + 48 = 80 г/моль,
молярная масса NaOH: М(NaOH) = 23 + 16 + 1 = 40 г/моль,
количество вещества оксида серы VI:
ν(SO₃) = m(SO₃) : М(SO₃) = (20 г) : (80 г/моль) = = 0,25 моль.
SO₃ + 2NaOH → Na₂SO₄ + H₂O. На один моль оксида серы VI приходится два моля гидроксида натрия ⇒ ν(NaOH) = 2ν(SO₃) = 2·0,25 = 0,5 моль;
масса NaOH равна: m(NaOH) = М(NaOH)·ν(NaOH) = 40·0,5 = 20 грамм,
η(NaOH) = [m(NaOH) · 100%] : m(раствора) ⇒ масса раствора равна:
m(раствора) = [m(NaOH) · 100%] : η(NaOH) = = 166,7 г
ответ: масса раствора равна 166,7 грамм
Al —> AlCl₃ —> Al(OH)₃ —> Al₂O₃ —> AlCl₃ —> AlPO₄
1) 2 Al + 3 Cl₂ ===> 2 AlCl₃
• Расставим степени окисления:
2 Al⁰ + 3 Cl₂⁰ ===> 2 Al⁺³Cl₃⁻¹
• Баланс:
2 | Al⁰ –(-3ē)—> Al⁺³ | 6
3 | Cl₂⁰ —(+1ē • 2)—> 2 Cl⁻¹ | 6
Al⁰ - восстановитель, окисляется;
Cl₂⁰ - окислитель, восстанавливается.
2) AlCl₃ + 3 NaOH ===> Al(OH)₃↓ + 3 NaCl
3) 2 Al(OH)₃ ==(t°C)==> Al₂O₃ + 3 H₂O
4) Al₂O₃ + 6 HCl ===> 2 AlCl₃ + 3 H₂O
5) AlCl₃ + K₃PO₄ ===> AlPO₄↓ + 3 KCl
• Полное ионное уравнение:
Al⁺³ + 3 Cl⁻¹ + 3 K⁺¹ + PO₄⁻³ ===> AlPO₄↓ + 3 K⁺¹ + 3 Cl⁻¹
• Сокращённое ионное уравнение:
Al⁺³ + PO₄⁻³ ===> AlPO₄↓
Дано: m(SO₃) = 20 грамм, η(NaOH) = 12 % – концентрация раствора.
Уравнение реакции: SO₃ + 2NaOH → Na₂SO₄ + H₂O
молярная масса SO₃: М(SO₃) = 32 + 3·16= 32 + 48 = 80 г/моль,
молярная масса NaOH: М(NaOH) = 23 + 16 + 1 = 40 г/моль,
количество вещества оксида серы VI:
ν(SO₃) = m(SO₃) : М(SO₃) = (20 г) : (80 г/моль) =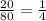 = 0,25 моль.
= 0,25 моль.
SO₃ + 2NaOH → Na₂SO₄ + H₂O. На один моль оксида серы VI приходится два моля гидроксида натрия ⇒ ν(NaOH) = 2ν(SO₃) = 2·0,25 = 0,5 моль;
масса NaOH равна: m(NaOH) = М(NaOH)·ν(NaOH) = 40·0,5 = 20 грамм,
η(NaOH) = [m(NaOH) · 100%] : m(раствора) ⇒ масса раствора равна:
m(раствора) = [m(NaOH) · 100%] : η(NaOH) =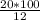 = 166,7 г
= 166,7 г
ответ: масса раствора равна 166,7 грамм
Al —> AlCl₃ —> Al(OH)₃ —> Al₂O₃ —> AlCl₃ —> AlPO₄
1) 2 Al + 3 Cl₂ ===> 2 AlCl₃
• Расставим степени окисления:
2 Al⁰ + 3 Cl₂⁰ ===> 2 Al⁺³Cl₃⁻¹
• Баланс:
2 | Al⁰ –(-3ē)—> Al⁺³ | 6
3 | Cl₂⁰ —(+1ē • 2)—> 2 Cl⁻¹ | 6
Al⁰ - восстановитель, окисляется;
Cl₂⁰ - окислитель, восстанавливается.
2) AlCl₃ + 3 NaOH ===> Al(OH)₃↓ + 3 NaCl
3) 2 Al(OH)₃ ==(t°C)==> Al₂O₃ + 3 H₂O
4) Al₂O₃ + 6 HCl ===> 2 AlCl₃ + 3 H₂O
5) AlCl₃ + K₃PO₄ ===> AlPO₄↓ + 3 KCl
• Полное ионное уравнение:
Al⁺³ + 3 Cl⁻¹ + 3 K⁺¹ + PO₄⁻³ ===> AlPO₄↓ + 3 K⁺¹ + 3 Cl⁻¹
• Сокращённое ионное уравнение:
Al⁺³ + PO₄⁻³ ===> AlPO₄↓