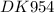Далее мы где решали уравнение полуреакций мы их находим в табличном значений, потом находим ЭДС и в итоге определим самопроизвольного протекания реакции между ними:
E(окислителя) = 1,33 В E(восстановителя) = 0,84 В
ε = E(окислителя) - E(восстановителя) = 1,33 В - 0,84 В = 0,49 В
ΔG = -ε = -(+0,49 В) = -0,49 В - протекает самопроизвольно
Теперь находим констант равновесия из полуреакций по уравнению Нернста:
lg K = ( n×(E(окислителя) - E(восстановителя) ) / 0,059 , где
Электронная формула иона Рбидия:
₊₃₇Rb⁻ 1s²2s²2p⁶3s²3p⁶3d¹⁰4s²4p⁶
Электронно-графическая формула иона Рубидия ₊₃₇ Rb⁻ :
p ⇅⇅⇅
4 уровень s ⇅
d ⇅⇅⇅⇅⇅
p ⇅⇅⇅
3 уровень s ⇵
p ⇅⇅⇅
2 уровень s⇅
1 уровень s⇅
2) Ион Хлора:
Электронная формула иона Хлора ₊₁₇CI⁻ 1s²2s²2p⁶3s²3p⁶
Электронно-графическая формула иона Хлора ₊₁₇CI⁻:
p ⇅⇅⇅
3 уровень s ⇵
p ⇅⇅⇅
2 уровень s⇅
1 уровень s⇅
K₂Cr₂O₇ + KNO₂ + H₂SO₄ → Cr₂(SO₄)₃ + KNO₃ + K₂SO₄ + H₂O
2K⁺ + Cr₂O₇²⁻ + K⁺ + NO₂⁻ + 2H⁺ + SO₄²⁻ → 2Cr³⁺ + 3SO₄²⁻ + K⁺ + NO₃⁻ + 2K⁺ + SO₄²⁻ + H₂O
Cr₂O₇²⁻ + NO₂⁻ + 2H⁺ → 2Cr³⁺ + NO₃⁻ + H₂O
Cr₂O₇²⁻ + 14H⁺ + 6e⁻ → 2Cr³⁺ + 7H₂O | 6 | | 1 | - окислитель
| | 6 | |
NO₂⁻ + H₂O - 2е⁻ → NO₃⁻ + 2H⁺ | 2 | | 3 | - восстановитель
---------------------------------------------------------------------------------------------------------
Cr₂O₇²⁻ + 14H⁺ + 6e⁻ + 3NO₂⁻ + 3H₂O - 6е⁻ → 2Cr³⁺ + 7H₂O + 3NO₃⁻ + 6H⁺
Cr₂O₇²⁻ + 3NO₂⁻ + 8H⁺ → 2Cr³⁺ + 4H₂O + 3NO₃⁻
2K⁺ + Cr₂O₇²⁻ + 3K⁺ + 3NO₂⁻ + 8H⁺ + 4SO₄²⁻ → 2Cr³⁺ + 3SO₄²⁻ + 3K⁺ + 3NO₃⁻ + 2K⁺ + SO₄²⁻ + 4H₂O
В итоге получаем:
K₂Cr₂O₇ + 3KNO₂ + 4H₂SO₄ → Cr₂(SO₄)₃ + 3KNO₃ + K₂SO₄ + 4H₂O
Далее мы где решали уравнение полуреакций мы их находим в табличном значений, потом находим ЭДС и в итоге определим самопроизвольного протекания реакции между ними:
E(окислителя) = 1,33 В E(восстановителя) = 0,84 В
ε = E(окислителя) - E(восстановителя) = 1,33 В - 0,84 В = 0,49 В
ΔG = -ε = -(+0,49 В) = -0,49 В - протекает самопроизвольно
Теперь находим констант равновесия из полуреакций по уравнению Нернста:
lg K = ( n×(E(окислителя) - E(восстановителя) ) / 0,059 , где
n - общее число электронов
lg K = ( 6×(1,33 - 0,84) ) / 0,059
lg K = ( 6×0,49 ) / 0,059
lg K = 2,94 / 0,059
lg K ≈ 49,83 ⇒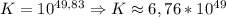
ответ: ε = 0,49 В, ΔG = -0,49 В ,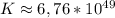
Решено от :