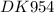Молекулярное уравнение:Fe(NO3)3 + HOH ⇄ FeOH(NO3)2 + HNO3
Полное ионное уравнение:Fe3+ + 3NO3- + HOH ⇄ FeOH2+ + 2NO3- + H+ + NO3-
Краткое ионное уравнение:Fe3+ + HOH ⇄ FeOH2+ + H+
Молекулярное уравнение:FeOH(NO3)2 + H2O ⇄ Fe(OH)2NO3 + HNO3
Полное ионное уравнение:FeOH2+ + 2NO3- + H2O ⇄ Fe(OH)2+ + NO3- + H+ + NO3-
Краткое ионное уравнение:FeOH2+ + H2O ⇄ Fe(OH)2+ + H+
Молекулярное уравнение:Fe(OH)2NO3 + H2O ⇄ Fe(OH)3 + HNO3
Полное ионное уравнение:Fe(OH)2+ + NO3- + H2O ⇄ Fe(OH)3 + H+ + NO3-
Краткое ионное уравнение:Fe(OH)2+ + H2O ⇄ Fe(OH)3 + H+
Т.к. в результате гидролиза образовались ионы водорода (H+), то раствор будет имееть кислую среду (pH < 7).
K2SO3
Первая стадия гидролиза
Молекулярное уравнение:K2SO3 + H2O ⇄ KOH + KHSO3
Полное ионное уравнение:2K+ + SO32- + H2O ⇄ K+ + OH- + K+ + HSO3-
Краткое ионное уравнение:SO32- + H2O ⇄ HSO3- + OH-
Молекулярное уравнение:KHSO3 + H2O ⇄ KOH + H2SO3
Полное ионное уравнение:K+ + HSO3- + H2O ⇄ K+ + OH- + H2SO3
Краткое ионное уравнение:HSO3- + H2O ⇄ H2SO3 + OH-
Т.к. в результате гидролиза образовались гидроксид-ионы (OH-), то раствор будет имееть щелочную среду (pH > 7).
Дано:
m(C₁₂H₂₂O₁₁) = 342 гр
Найти:
N(AТФ) - ?
1) Сахароза – дисахарид и состоит из α-D-глюкозы и β-D-фруктозы, их энергетическая ценность при окислении одинакова.
C₁₂H₂₂O₁₁ + H₂O (H⁺ , t°C)→ C₆H₁₂O₆ + C₆H₁₂O₆
Сахароза α-D-глюкоза β-D-фруктоза
2) Для начала мы найдем молекулярную массу сахарозы, а потом находим количества молекул у сахарозы а потом у глюкозы:
M(C₁₂H₂₂O₁₁) = 12×12 + 1×22 + 16×11 = 144 + 22 + 176 = 342 гр/моль
n(C₁₂H₂₂O₁₁) = m(C₁₂H₂₂O₁₁)/M(C₁₂H₂₂O₁₁) = 342 гр / 342 гр/моль = 1 моль ⇒ n(C₆H₁₂O₆) = n(C₁₂H₂₂O₁₁) = 1 моль
3) Теперь находим количества вещества у сахарозы:
N(C₁₂H₂₂O₁₁) = n(C₁₂H₂₂O₁₁)× = 1 моль × 6,02×10²³ (моль)⁻¹ = 6,02×10²³ молекул
4) Теперь найдем сколько молекул АТФ образовалось в результате анаэробного и аэробного условия, зная что в результате анаэробного условия образуется 3 молекулы АТФ, а в результате аэробного условия 38 молекул (в расчёте на 1 молекулу глюкозы):
N(АТФ) = n(АТФ)× = 3 моль × 6,02×10²³ (моль)⁻¹ = 18,06×10²³ молекул - при анаэробном условий.
N(АТФ) = n(АТФ)× = 38 моль × 6,02×10²³ (моль)⁻¹ = 228,76×10²³ молекул - при аэробном условий.
ответ: N(АТФ) = 18,06×10²³ молекул - при анаэробном условий.
N(АТФ) = 228,76×10²³ молекул - при аэробном условий.
Решено от :
Первая стадия гидролиза
Молекулярное уравнение:
Fe(NO3)3 + HOH ⇄ FeOH(NO3)2 + HNO3
Полное ионное уравнение:
Fe3+ + 3NO3- + HOH ⇄ FeOH2+ + 2NO3- + H+ + NO3-
Краткое ионное уравнение:
Вторая стадия гидролизаFe3+ + HOH ⇄ FeOH2+ + H+
Молекулярное уравнение:
FeOH(NO3)2 + H2O ⇄ Fe(OH)2NO3 + HNO3
Полное ионное уравнение:
FeOH2+ + 2NO3- + H2O ⇄ Fe(OH)2+ + NO3- + H+ + NO3-
Краткое ионное уравнение:
Третья стадия гидролизаFeOH2+ + H2O ⇄ Fe(OH)2+ + H+
Молекулярное уравнение:
Fe(OH)2NO3 + H2O ⇄ Fe(OH)3 + HNO3
Полное ионное уравнение:
Fe(OH)2+ + NO3- + H2O ⇄ Fe(OH)3 + H+ + NO3-
Краткое ионное уравнение:
Fe(OH)2+ + H2O ⇄ Fe(OH)3 + H+
Т.к. в результате гидролиза образовались ионы водорода (H+), то раствор будет имееть кислую среду (pH < 7).
K2SO3
Первая стадия гидролиза
Молекулярное уравнение:
K2SO3 + H2O ⇄ KOH + KHSO3
Полное ионное уравнение:
2K+ + SO32- + H2O ⇄ K+ + OH- + K+ + HSO3-
Краткое ионное уравнение:
Вторая стадия гидролизаSO32- + H2O ⇄ HSO3- + OH-
Молекулярное уравнение:
KHSO3 + H2O ⇄ KOH + H2SO3
Полное ионное уравнение:
K+ + HSO3- + H2O ⇄ K+ + OH- + H2SO3
Краткое ионное уравнение:
HSO3- + H2O ⇄ H2SO3 + OH-
Т.к. в результате гидролиза образовались гидроксид-ионы (OH-), то раствор будет имееть щелочную среду (pH > 7).
Дано:
m(C₁₂H₂₂O₁₁) = 342 гр
Найти:
N(AТФ) - ?
1) Сахароза – дисахарид и состоит из α-D-глюкозы и β-D-фруктозы, их энергетическая ценность при окислении одинакова.
C₁₂H₂₂O₁₁ + H₂O (H⁺ , t°C)→ C₆H₁₂O₆ + C₆H₁₂O₆
Сахароза α-D-глюкоза β-D-фруктоза
2) Для начала мы найдем молекулярную массу сахарозы, а потом находим количества молекул у сахарозы а потом у глюкозы:
M(C₁₂H₂₂O₁₁) = 12×12 + 1×22 + 16×11 = 144 + 22 + 176 = 342 гр/моль
n(C₁₂H₂₂O₁₁) = m(C₁₂H₂₂O₁₁)/M(C₁₂H₂₂O₁₁) = 342 гр / 342 гр/моль = 1 моль ⇒ n(C₆H₁₂O₆) = n(C₁₂H₂₂O₁₁) = 1 моль
3) Теперь находим количества вещества у сахарозы:
N(C₁₂H₂₂O₁₁) = n(C₁₂H₂₂O₁₁)×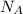 = 1 моль × 6,02×10²³ (моль)⁻¹ = 6,02×10²³ молекул
= 1 моль × 6,02×10²³ (моль)⁻¹ = 6,02×10²³ молекул
4) Теперь найдем сколько молекул АТФ образовалось в результате анаэробного и аэробного условия, зная что в результате анаэробного условия образуется 3 молекулы АТФ, а в результате аэробного условия 38 молекул (в расчёте на 1 молекулу глюкозы):
N(АТФ) = n(АТФ)×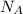 = 3 моль × 6,02×10²³ (моль)⁻¹ = 18,06×10²³ молекул - при анаэробном условий.
= 3 моль × 6,02×10²³ (моль)⁻¹ = 18,06×10²³ молекул - при анаэробном условий.
N(АТФ) = n(АТФ)×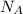 = 38 моль × 6,02×10²³ (моль)⁻¹ = 228,76×10²³ молекул - при аэробном условий.
= 38 моль × 6,02×10²³ (моль)⁻¹ = 228,76×10²³ молекул - при аэробном условий.
ответ: N(АТФ) = 18,06×10²³ молекул - при анаэробном условий.
N(АТФ) = 228,76×10²³ молекул - при аэробном условий.
Решено от :