КОНТРОЛЬНАЯ Типы химической связи
Вариант 1
1. Выберите определение химической связи:
а) силы, связывающие ядра и электроны между собой;
б) энергетически выгодное взаимодействие между атома¬ми, молекулами, ионами в веществе;
в) силы, действующие между протонами и нейтронами в ядре атома;
г) изменения, происходящие с атомом одного элемента под влиянием атома другого элемента.
2. Выберите частицу, образующуюся при присоединении электронов к атому:
а) анион; б) катион; в) возбужденный атом; г) радикал.
3. Выберите ряд, в котором перечислены соединения с ковалентным полярным видом связи. Запишите схемы образования их молекул:
а) O2, N2, Вг2; в) СаС12 , ВаI2, К2S;
б) НВг, РH3, Н2S; г) NaCl, СаО, К2S.
4. Выберите вид химической связи, образовавшейся за счет пары электронов, расположенных на одинаковом расстоянии от обоих атомов:
а) металлическая; б) ковалентная полярная;
в) ковалентная неполярная; г) водородная
5. Выберите ряд, в котором перечислены соединения с ковалентным неполярным видом связи:
а) Р2О3, Н2S, SO3, SО2; б) NaCl, СаС12, СаО, К2S
в) N2, CL2, H2, O2 г ) РН3, NН3, Н2S, Н2O
6. Выберите химический элемент, который больше отдавать электроны, чем присоединять:
а) Азот; б) Кислород; в) Натрий; г) Водород.
7. Разместите вещества в порядке возрастания полярности химической связи в молекуле:
а) НС1; б) НВг; в) НI г)НF.
8. Выберите полярную молекулу:
а) СО2; б) N2; в) Н2S; г) O2
9. Ионная связь образуется ионами:
а) Вr - и Сl -; б) Nа + и К+; в) Ва2- и F- г) S2- и H+.
10. Установите соответствие между формулами веществ и видом химической связи.
Формула вещества:
1) NaH;
2) O3;
3) NH3;
4) KCl Химическая связь:
а) ковалентная полярная;
б) ковалентная неполярная;
в) донорно-акцепторная;
г) ионная;
д) водородная;
е) металлическая
Формула относительной плотности того, или иного вещества по другому:
Тут D - относительная плотность вещества Y по веществу X.
Mr - относительная молекулярная масса веществ.
В случае аммиака и какого-то газа, которого мы не знаем:
Выводим формулу для относительной молекулярной массы для вещества X.
Подставляем известные нам значения:
Так как относительная молекулярная масса для истинной формулы меньше относительной молекулярной массы его простейшей(эмпирической) формулы, то задача не может быть решена.
ответ: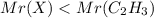 , поэтому решения нет.
, поэтому решения нет.
Длина связи - расстояние между ядрами соседних химически связанных атомов, при котором энергия системы минимальна. При увеличении кратности связи ее длина уменьшается, а энергия связи – увеличивается, а при одинаковой кратности - чем меньше длина, тем больше энергия связи. Например, длина связи в различных видах связи атомов углерода равна:
(С-С) - 0.154 нм (энергия одинарной связи - 356 Дж/моль)
(С=С) - 0.134 нм (энергия двойной связи - 598 Дж/моль)
(С≡С) - 0.12 нм (энергия тройной связи - 813 Дж/моль).
Длина связи зависит также от гибридизации, например, для связи (С-Н) она равна (в нм – в нанометрах):
-при р-гибридизации (для радикала CH) - 0.1120
-при sp3-гибридизации (для метана CH4) - 0.1090
-при sp2-гибридизации (для этилена C2H4) - 0.1069
-при sp-гибридизации (для ацетилена C2H2) - 0.1060
Энергия связи [кДж/моль] - величина работы, необходимой для разрыва одной химической связи во всех молекулах, составляющих (1 моль) вещества. Она тем выше, чем больше энергии затрачивается при связывании отдельных атомов). Энергия связи показывает прочность связи. Энергия связи между двумя атомами зависит от кратности связи: с увеличением кратности энергия связи возрастает. Например, энергия:
- одинарной связи углерода ( C ) в молекуле этана (С2Н6) равна 263 кДж/моль
- двойной связи углерода (С=С) в этилене (С2Н4) равна 422 кДж/моль
- тройной связи углерода (C≡C) в молекуле ацетилена (С2Н2) равна 535 кДж/моль).
Прочность связей увеличиваются в ряду p-, sр3 -, sp2 -, sp-орбиталей и при включении в гибридизацию d-орбиталей. Энергии связи двухатомной молекулы соответствует энергия термической диссоциации, а энергии связи атомного ядра - дефект массы.
Валентные углы - углы между двумя воображаемыми линиями связей в химическом соединении. Они определяют геометрическую пространственную конфигурацию молекул. Например, в молекулах CH4, NH3 и H2O валентные орбитали центральных атомов находятся в одинаковом гибридном состоянии, однако углы между связями не равны: в CH4 он равен 109o, в NH3 - 107o, a в H2O - 105o .