Легкие , но не для меня)) решите подробно)) 1. напишите уравнения реакции h2+o2= mg+hcl= feo+h2= hi+h2o= 2.найдите массу водорода и кислорода, которые образуются при разложении 270 гр воды электрическим током 3. определите массовые доли элементов в азотной кислоте. 4.определите формулу водородосодержащего соединения азота, если известно, что массовая доля водорода в нем 17,64%.
Задачка №1
Думаю, что в этом задании трудностей не должно возникнуть
Задачка №2
Такие задачки решают через уравнени реакции:
Вот собственно и оно:
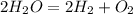
Теперь вычислим количество вещества воды:
Теперьт анализируем уравнение реакции и в результате анализа узавнем, что количество вещества воды равно количеству вещества водорода:
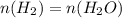 = 15 моль
= 15 моль
По тому же анализу выводим, что количество вещества кислорода в два раза меньше, т.е. 15/5 = 7,5моль
И считаем массу:
m(водорода) = n*M = 15моль*2г/моль = 30 грамм
m(кислорода) = M*n = 7,5моль*32г/моль = 240 грамм
Задачка №3
На массовые доли еще проще.
Сначала вычислим молекулярную массу вещества:
Mr(HNO3) = Ar(H) + Ar(N) + 3Ar(O) = 1 + 14 + 48 = 63
Теперь, чтобы узначть массовую долю каждого элемента, надо Ar каждого из них, и водорода, и кислорода, и азота, поделить на молекулярную массу, на 63, в общем виде:
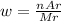 - n показывает сколько элемента в молекуле, водорода с азото по одному, поэтому n = 1, кислорода три, значит n = 3
- n показывает сколько элемента в молекуле, водорода с азото по одному, поэтому n = 1, кислорода три, значит n = 3
Считаем массовые доли:
Задача №4
Это аммиак NH3
Пусть n - число атомов водорода, а - m - число атомов азота, молярные массы водорода и азота равны 1 и 14 сответственнно.
Тогда
n/(n*1 + m*14) = 0.17
n = 0.17n + 2.38m
0.83n = 2.38m
n/m = 2.38/0.83 ~ 3
Значит отношение атомов водорода и азота равно 3
NH3