Мініпроект використовуючи додаткові джерела інформації порівняйте внесок у формування парникового ефекту парникових газів які потрапляють в атмосферу з природних та антропогенних джерел
В результате сгорания углерода на воздухе образуется углекислый газ:
\[ C + O_2 \rightarrow CO_2 (600 - 700^{0}C).\]
Пропуская диоксид углерода через воду можно получить раствор угольной кислоты (реакция носит обратимый характер):
\[CO_2 + H_2O \rightarrow H_2CO_3.\]
Уравнение реакции получения карбоната натрия из угольной кислоты посредством её взаимодействия с гидроксидом натрия можно записать условно, поскольку данная кислота является неустойчивым соединением:
\[H_2CO_3 + 2NaOH \rightarrow Na_2CO_3 + H_2O.\]
В реальности соли угольной кислоты могут быть получены или действием диоксида углерода на щелочи, или путем обменных реакций между растворимыми солями угольной кислоты и солями других кислот. Например:
При действии кислот, даже таких слабых, как уксусная, все карбонаты разлагаются с выделением диоксида углерода. Этой реакцией часто пользуются для открытия карбонатов, так как выделение CO_2, легко обнаружить по характерному шипению.
При нагревании все карбонаты, кроме солей щелочных металлов, разлагаются с выделением CO_2. Продуктами разложения в большинстве случаев являются оксиды соответствующих металлов.
1) 13,44 л
2) 9,6 г
Объяснение:
1) Формула: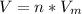 , где n - количество вещества (моль);
, где n - количество вещества (моль); 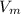 - молярный объем, который для всех газов при нормальных условиях равен 22,4 л/моль
- молярный объем, который для всех газов при нормальных условиях равен 22,4 л/моль
Подставляем и решаем: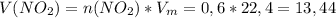 л
л
2) Формула количества молекул: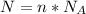 , где N - число молекул; n - количество вещества (моль);
, где N - число молекул; n - количество вещества (моль); 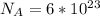 - число Авогадро (1/моль).
- число Авогадро (1/моль).
Из этой формулы нужно найти количество вещества →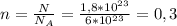 моль
моль
Далее используем формулу: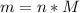 , где M - молярная масса вещества (г/моль)
, где M - молярная масса вещества (г/моль)
Молярная масса считается как сумма атомных масс элементов, входящих в вещество. Атомные массы даны в таблице Менделеева.
Цепочка превращений:
C -> CO2 -> H2CO3 -> Na2CO3.
В результате сгорания углерода на воздухе образуется углекислый газ:
\[ C + O_2 \rightarrow CO_2 (600 - 700^{0}C).\]
Пропуская диоксид углерода через воду можно получить раствор угольной кислоты (реакция носит обратимый характер):
\[CO_2 + H_2O \rightarrow H_2CO_3.\]
Уравнение реакции получения карбоната натрия из угольной кислоты посредством её взаимодействия с гидроксидом натрия можно записать условно, поскольку данная кислота является неустойчивым соединением:
\[H_2CO_3 + 2NaOH \rightarrow Na_2CO_3 + H_2O.\]
В реальности соли угольной кислоты могут быть получены или действием диоксида углерода на щелочи, или путем обменных реакций между растворимыми солями угольной кислоты и солями других кислот. Например:
\[NaOH + CO_2 \rightarrow NaHCO_3;\]
\[ NaHCO_3 + NaOH \rightarrow Na_2CO_3 + H_2O;\]
\[BaCl_2 + Na_2CO_3 \rightarrow BaCO_3_{solid} + 2NaCl.\]
При действии кислот, даже таких слабых, как уксусная, все карбонаты разлагаются с выделением диоксида углерода. Этой реакцией часто пользуются для открытия карбонатов, так как выделение CO_2, легко обнаружить по характерному шипению.
При нагревании все карбонаты, кроме солей щелочных металлов, разлагаются с выделением CO_2. Продуктами разложения в большинстве случаев являются оксиды соответствующих металлов.