Метод электронного баланса можно разделить на несколько этапов:
1) Найти окислитель и восстановитель.
2) Составить полуреакции перехода электронов
3) Уравнять число принятых и отданных электронов в данной полуреакции
4) Просуммировать левые и правые части полуреакций.
5) Расставить недостающие коэффициенты у элементов,которые не меняли степень окисления (СО)
Например:
1 Этап:
Азот в из СО +5 перешел в СО +2 в , он принял электроны => является окислителем.
Медь в из СО +1 перешла в СО +2 в , она отдала электроны => является восстановителем.
2 Этап:
( !Нужно учитывать, что в 2 атома меди, поэтому было отдано 2 электрона)
3 Этап:
Число принятых и отданных электронов должно быть одинаково, поэтому надо домножить каждую из полуреакций на такое число, чтобы их было поровну, в данном случае по 6 электронов
| * 2
| * 3
4 Этап:
Сокращаем электроны:
5 Этап:
В левой части меньше азота, чем в правой, поэтому увеличиваем коэффициент перед азотной кислотой на 12 (столько не хватает азота)
Теперь в левой части больше кислорода чем в правой, поэтому увеличиваем коэффициент перед водой на 7 (столько не хватает кислорода)
Проверяем кол-во водорода в правой и левой части. И там, и там их поровну (14) => коэффициенты расставлены
Определяем молекулярную массу вещества, складывая атомные массы ( из Периодической системы элементов Д.И.Менделеева), умноженные на индексы, представленные в формуле вещества:
Mr(Na₂CO₃) = 2·23 +12 + 3·16 = 106г/моль.
Концентрация Cm требуемого раствора 0,2М, т.е. 0,2моль в 1 л раствора. А его надо V =2 л:
m = Cm·Mr·V = 0,2моль/л·106г/моль·2л = 42,4г
Формулу для определения массы вещества, необходимого для получения требуемого объема заданной концентрации, хорошо бы запомнить: обязательно пригодится и в школе, и в домашнем хозяйстве!
Метод электронного баланса можно разделить на несколько этапов:
1) Найти окислитель и восстановитель.
2) Составить полуреакции перехода электронов
3) Уравнять число принятых и отданных электронов в данной полуреакции
4) Просуммировать левые и правые части полуреакций.
5) Расставить недостающие коэффициенты у элементов,которые не меняли степень окисления (СО)
Например:
1 Этап:
Азот в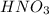 из СО +5 перешел в СО +2 в
из СО +5 перешел в СО +2 в 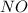 , он принял электроны => является окислителем.
, он принял электроны => является окислителем.
Медь в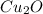 из СО +1 перешла в СО +2 в
из СО +1 перешла в СО +2 в 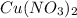 , она отдала электроны => является восстановителем.
, она отдала электроны => является восстановителем.
2 Этап:
( !Нужно учитывать, что в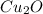 2 атома меди, поэтому было отдано 2 электрона)
2 атома меди, поэтому было отдано 2 электрона)
3 Этап:
Число принятых и отданных электронов должно быть одинаково, поэтому надо домножить каждую из полуреакций на такое число, чтобы их было поровну, в данном случае по 6 электронов
4 Этап:
Сокращаем электроны:
5 Этап:
В левой части меньше азота, чем в правой, поэтому увеличиваем коэффициент перед азотной кислотой на 12 (столько не хватает азота)
Теперь в левой части больше кислорода чем в правой, поэтому увеличиваем коэффициент перед водой на 7 (столько не хватает кислорода)
Проверяем кол-во водорода в правой и левой части. И там, и там их поровну (14) => коэффициенты расставлены
Эти задачи решаются так:
Определяем молекулярную массу вещества, складывая атомные массы ( из Периодической системы элементов Д.И.Менделеева), умноженные на индексы, представленные в формуле вещества:
Mr(Na₂CO₃) = 2·23 +12 + 3·16 = 106г/моль.
Концентрация Cm требуемого раствора 0,2М, т.е. 0,2моль в 1 л раствора. А его надо V =2 л:
m = Cm·Mr·V = 0,2моль/л·106г/моль·2л = 42,4г
Формулу для определения массы вещества, необходимого для получения требуемого объема заданной концентрации, хорошо бы запомнить: обязательно пригодится и в школе, и в домашнем хозяйстве!