Майская погода переменчива. чтобы дождь не мешал празднованию дня победы, над москвой в этот день довольно часто "разгоняют" облака. против слоистых форм нижнего облачного слоя с высоты в несколько тысяч метров с самолетов рассыпают сухой лед. в случае слоисто-дождевой облачности применяется жидкий азот. наиболее мощные дождевые облака бомбардируют иодидом серебра. при этом для очистки 1тыс.км2 неба достаточно 10 г иодида серебра. под действием света иодид серебра разлагается на серебро и иод. вычислите, сколько граммов серебра выпадет на землю при очистке неба над москвой, если площадь москвы составляет 2561,5км2.
1) Гидрирование (с образованием первичных спиртов):
H₃C-COH+H₂→H₃C-CH₂-OH
2) Присоединение гидросульфита натрия (только для алициклических):
H₃C-COH+NaHSO₃→H₃C-C-SO₃Na
|
OH
3) Присоединение синильной кислоты (образование гидроксинитрилов, или циангидринов): H₃C-COH+HCN→H₃C-CH-CN
|
OH
4) Присоединение спиртов (образование ацеталей):
R-COH+H₃-CH₂-OH⇄R-CH-O-CH₂-CH₃
| полуацеталь
OH
R-CH-O-CH₂-CH₃ R-CH-O-CH₂-CH₃
| +H₃C-CH₂-OH⇄ | ацеталь
OH O-CH₂-CH₃
5) Гидратация: CH₂=O+H₂O→H₂C(OH)₂ гидрат формальдегида
6) Присоединение реактива Гриньяра:
R-COH+H₃C-CH₂-MgI→R-CH-CH₂-CH₃
|
O-MgI
R-CH-CH₂-CH₃ R-CH-CH₂-CH₃
| +H₂O→ | +Mg(OH)I
O-MgI OH
7) Полимеризация (циклическая и линейная)
7.1) линейная: под действием света происходит линейная полимеризация 40%-ного водного раствора формальдегида с образованием параформа (картинка внизу).
7.2) циклическая: альдегиды самопроизвольно или под действием кислот могут вступать в реакции тримеризации и тетрамеризации, при этом образуются шести- и восьмичленные циклы с чередующимися атомами углерода и кислорода в молекуле (картинка внизу).
8) Поликонденсация: реакции поликонденсации – это процесс образования полимеров из низкомолекулярных веществ, сопровождающийся отщеплением побочных низкомолекулярных веществ – воды, спирта, галогеноводородов и т.д. Альдегиды вступают в реакцию поликонденсации с фенолом (анилином и т.д.) с образованием соответствующих полимерных смол. Реакции протекают ступенчато: сначала образуется димер, затем тример и т.д. (картинка внизу).
9) Конденсация (картинка внизу).
10) Горение: CnH2nO+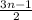 O₂→nCO₂↑+nH₂O
O₂→nCO₂↑+nH₂O
11) Реакции окисления. Альдегиды легко окисляются до кислот даже слабыми окислителями, такими как аммиачный раствор оксида серебра (Ag₂O/NH₃, или [Ag(NH₃)₂]OH), а также свежеосажденным гидроксидом меди (II):
11.1) реакция "серебряного зеркала": R-COH+2[Ag(NH₃)₂]OH→R-COONH₄ (или RCOOH) + 2Ag↓+3NH₃↑ (или 4NH₃↑)+H₂O
Исключение для формальдегида: HCOH+4[Ag(NH₃)₂]OH→(NH₄)₂CO₃+4Ag↓+6NH₃↑+2H₂O
11.2) R-COH+2Cu(OH)₂→R-COOH+Cu₂O↓+2H₂O
12) Реакции замещения с соединениями, содержащими аминогруппу (картинка внизу).
13) Взаимодействие с пентахлоридом фосфора:
R-COH+PCl₅→R-CH-Cl+POCl₃
|
Cl
14) Замещение атома водорода в радикале в α-положении к карбонильной группе (например, галогенирование). Сильно поляризованная карбонильная группа в молекулах альдегидов и кетонов вызывает понижение электронной плотности (δ+) на атомах углерода в α-положении, вследствие чего атомы водорода приобретают повышенную реакционную и могут отщепляться в виде протона:
H₃C-CH₂-CH₂-COH+Br₂→H₃C-CH₂-CH-COH+HBr
|
Br
CO2-оксид углерода/угарный газ (кислотный оксид);
N2O5-оксид азота(v) (кислотный оксид);
Fe2O3-оксид железа(|||)
2) взаимодействует
а) с основными и амфотерными оксидами:
CuO+2HNO3—>Cu(NO3)2+H2O;
ZnO+2HNO3—>Zn(NO3)2+H2O
б)с основаниями:
KOH+HNO3—>KNO3+H2O
в) вытесняет слабые кислоты из их солей:
CaCO3+2HNO3—>Ca(NO3)2+H2O+CO2
3) 1. 2Cu+O2—>2CuO(при нагреве) ;
2.CuO+2HNO3—>Cu(NO3)2+H2O;
3.Cu(NO3)2+2NaOH—>Cu(OH)2+2NaNO3
4)SO2+H2O—>H2SO3;
Mg(OH)2+2HNO3—>M(NO3)2+2H2O;
NaNO3+K2S-реакция не идёт
CuSO4+NaOH—>Cu(OH)2 (выпадает в осадок) +Na2SO4
5) Na2CO3+CuCl2—>2NaCl+CuCO3 (выпадает в осадок)
6) ZnCl2+Ag2SO4—>ZnSO4+2AgCl (выпадает в осадок)
7) Ca(OH) 2+H2SO4—>CaSO4+2H2O