Метан объёмом 22,4 л насыщен водяным паром при 20 (С и давлении 0,986(105 Па. Давление пара воды при этой температуре равно 2,33 кПа. Чему равна масса метана в данном объеме?
1.кислородсодержащие органические соединения, в которых атом Водорода, замещен на одну карбоксильную группу, называются предельные одноосновные кислоты.
2.муравьиную кислоту можно получить действием на ее соли более сильными кислотами,например,серной.А ее соль можно получить,пропуская угарный газ через нагретую щелочь
3.Фенол обладает следующими физическими свойствами:бесцветное кристаллическое вещество со специфическим запахом,температурой плавления 42,3 градуса по Цельсию,температурой кипения 181,1 градуса,довольно трудно растворим в воде,на воздухе окисляется(краснеет) и кристаллы его расплываются.
4.область применения формальдегида:в производстве пластмасс,в кожевенном деле для дубления кожи,медицине и санитарии - для дезинфекции,40%-водный раствор называют формалином и применяют в семеноводстве для протравливания зерна от грибковых заболеваний
№2 составить формулу: 3-этилгептаналь:
7 6 5 4 3 2 1
| |
№3 закончить уравнение следующих реакций, укажите условия протекания, назовите вещества:
С2Н2--->СН3СОН--->С2Н5ОН--->НСООС2Н5 1)(в присутствии раствора сульфата ртути)- реакция Кучерова
2)(в присутствии никеля)
3)(при незначительном нагревании в присутствии концентрированной серной кислоты)
2) Определим количества вещества C₃H₇ОН и Na, вступивших в реакцию М(C₃H₇ОН) = 12 * 3 + 1 * 7 + 16 + 1 = 60 г/моль n(C₃H₇OH) = 180 : 60 = 3 моль По уравнению реакции с 2 моль C₃H₇OH реагирует 2 моль Na, следовательно, n(Na) = n(C₃H₇OН) = 3 моль
3) Определим массу Na, вступившего в реакцию с пропанолом-1 М(Na) = 23 г/моль m(Na) = 23 * 3 = 69 г
4) Определим объём водорода, выделившегося в ходе реакции пропанола-1 с натрием По уравнению реакции видно, что 1 моль Н₂ получается либо из 2 моль Na, либо из 2 моль C₃H₇OH, следовательно, n(Н₂) = 3 * 1 : 2 = 1,5 моль т.к. все вещества реагируют полностью, без избытка, то расчет ведем по любому из веществ по закону Авогадро: 1 моль любого газа занимает объём, равный 22,4 л V(H₂) = 1,5 * 22,4 = 33,6 л
5) Определим массу чистой воды, вступившей в реакцию m(Н₂О) = 200 * 10 : 100 = 20 г
6) Определим количества вещества Н₂О и Na, вступивших в реакцию М(Н₂О) = 1 * 2 = 16 = 18 г/моль n(Н₂) = 20 : 18 = 1,1111 моль По уравнению реакции с 2 моль Н₂О реагирует 2 моль Na, следовательно, n(Na) = n(Н₂О) = 1,1111 моль
7) Определим массу Na, вступившего в реакцию с водой М(Na) = 23 г/моль m(Na) = 23 * 1,1111 = 25,56 г
8) Определим объём водорода, выделившегося в ходе реакции воды с натрием по уравнению реакции видно, что 1 моль Н₂ получается либо из 2 моль Na, либо из 2 моль Н₂О, следовательно, n(Н₂) = 1,1111 * 1 : 2 = 0,5556 моль т.к. все вещества реагируют полностью, без избытка, то расчет ведем по любому из веществ по закону Авогадро: 1 моль любого газа занимает объём, равный 22,4 л V(H₂) = 0,5556 * 22,4 = 12,44 л
9) Определим общую массу натрия, вступившего в реакцию m(Na) = 69 + 25,56 = 94,56 г
10) Определим общий объём выделившегося водорода в ходе реакции V(H₂) = 33,6 + 12,44 = 46,04 л
1.кислородсодержащие органические соединения, в которых атом Водорода, замещен на одну карбоксильную группу, называются предельные одноосновные кислоты.
2.муравьиную кислоту можно получить действием на ее соли более сильными кислотами,например,серной.А ее соль можно получить,пропуская угарный газ через нагретую щелочь
3.Фенол обладает следующими физическими свойствами:бесцветное кристаллическое вещество со специфическим запахом,температурой плавления 42,3 градуса по Цельсию,температурой кипения 181,1 градуса,довольно трудно растворим в воде,на воздухе окисляется(краснеет) и кристаллы его расплываются.
4.область применения формальдегида:в производстве пластмасс,в кожевенном деле для дубления кожи,медицине и санитарии - для дезинфекции,40%-водный раствор называют формалином и применяют в семеноводстве для протравливания зерна от грибковых заболеваний
№2 составить формулу: 3-этилгептаналь:
7 6 5 4 3 2 1
| |
№3 закончить уравнение следующих реакций, укажите условия протекания, назовите вещества:
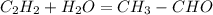 (в присутствии раствора сульфата ртути)- реакция Кучерова
(в присутствии раствора сульфата ртути)- реакция Кучерова
С2Н2--->СН3СОН--->С2Н5ОН--->НСООС2Н5
1)
2)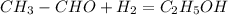 (в присутствии никеля)
(в присутствии никеля)
3)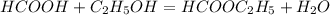 (при незначительном нагревании в присутствии концентрированной серной кислоты)
(при незначительном нагревании в присутствии концентрированной серной кислоты)
2Na + 2H₂O = 2NaOH + H₂↑
1) Определим массу чистого пропанола–1, вступившего в реакцию
w%(C₃H₇OH) = 100 % - 10 % = 90 %
m(C₃H₇OH) = 200 * 90 : 100 = 180г
2) Определим количества вещества C₃H₇ОН и Na, вступивших в реакцию
М(C₃H₇ОН) = 12 * 3 + 1 * 7 + 16 + 1 = 60 г/моль
n(C₃H₇OH) = 180 : 60 = 3 моль
По уравнению реакции с 2 моль C₃H₇OH реагирует 2 моль Na, следовательно,
n(Na) = n(C₃H₇OН) = 3 моль
3) Определим массу Na, вступившего в реакцию с пропанолом-1
М(Na) = 23 г/моль
m(Na) = 23 * 3 = 69 г
4) Определим объём водорода, выделившегося в ходе реакции пропанола-1 с натрием
По уравнению реакции видно, что 1 моль Н₂ получается либо из 2 моль Na, либо из 2 моль C₃H₇OH, следовательно,
n(Н₂) = 3 * 1 : 2 = 1,5 моль
т.к. все вещества реагируют полностью, без избытка, то расчет ведем по любому из веществ
по закону Авогадро: 1 моль любого газа занимает объём, равный 22,4 л
V(H₂) = 1,5 * 22,4 = 33,6 л
5) Определим массу чистой воды, вступившей в реакцию
m(Н₂О) = 200 * 10 : 100 = 20 г
6) Определим количества вещества Н₂О и Na, вступивших в реакцию
М(Н₂О) = 1 * 2 = 16 = 18 г/моль
n(Н₂) = 20 : 18 = 1,1111 моль
По уравнению реакции с 2 моль Н₂О реагирует 2 моль Na, следовательно,
n(Na) = n(Н₂О) = 1,1111 моль
7) Определим массу Na, вступившего в реакцию с водой
М(Na) = 23 г/моль
m(Na) = 23 * 1,1111 = 25,56 г
8) Определим объём водорода, выделившегося в ходе реакции воды с натрием
по уравнению реакции видно, что 1 моль Н₂ получается либо из 2 моль Na, либо из 2 моль Н₂О, следовательно,
n(Н₂) = 1,1111 * 1 : 2 = 0,5556 моль
т.к. все вещества реагируют полностью, без избытка, то расчет ведем по любому из веществ
по закону Авогадро: 1 моль любого газа занимает объём, равный 22,4 л
V(H₂) = 0,5556 * 22,4 = 12,44 л
9) Определим общую массу натрия, вступившего в реакцию
m(Na) = 69 + 25,56 = 94,56 г
10) Определим общий объём выделившегося водорода в ходе реакции
V(H₂) = 33,6 + 12,44 = 46,04 л