Много
обчисліть масу піриту, масова частка несульфідних домішок в якому становить 20 %, необхідного для добування сірчистого газу об’ємом 2 м^3 (н.
на :
вычислите массу пирита, массовая доля несульфидних примесей в котором составляет 20%, необходимого для получения сернистого газа объемом 2 м^3 (н.
Потребуется 146 г 20%-ной соляной кислоты.
Объяснение:
По уравнению реакции соляная кислота и гидроксид натрия реагируют в отношении 1 моль : 1 моль.
HCl + NaOH → NaCl + H₂O
Найдем количество вещества гидроксида натрия в 160 г 20%-ного раствора.
Масса гидроксида натрия в растворе: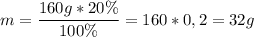 ;
;
Молярная масса M(NaOH) = 23 + 16 + 1 = 40 г/моль
Количество вещества: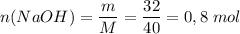
В реакцию вступило 0,8 моль гидроксида натрия и 0,8 моль соляной кислоты. Найдем массу соляной кислоты.
Молярная масса M(HCl) = 1 + 35,5 = 36,5 г/моль
Масса m(HCl) = n*M = 0,8 моль * 36,5 г/моль = 29,2 г.
⇒ В 20%-ном растворе соляной кислоты содержится 29,2 г чистого вещества HCl.
Найдем массу раствора соляной кислоты:
1) По справочнику физико-химических величин находим стандартные энтальпии образования каждого из веществ:
ΔН(СаО) = -635,09 кДж/моль
ΔН(Н₂О) = -285,83 кДж/моль
Δ(Са(ОН)₂) = -985,12 кДж/моль
2) Согласно следствию закона Гесса: Изменение энтальпии реакции равно разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ (с учетом стехиометрических коэффициентов в уравнении реакции)
ΔН(реакц) = -985,12 - (-635,09 - 285,83) = - 64,2 кДж
Т.к. ΔН(реакц) отрицательно, то тепло выделяется и реакция экзотермическая.
2) Данное значение ΔН(реакц) относится к 1 молю СаО.
Находим массу 1 моля СаО: М(СаО) = 40 + 16 = 56 г/моль
Тогда 224 г СаО составляют: 224/56 = 4 моля
Следовательно, изменение энтальпии, если в реакцию вступило 224 г СаО равно:
ΔН(реакц) = 4*(- 64,2) = - 256,9 кДж