Молекулярное, полное и ионное уравнения реакций между: 1) сернистой кислотой и гидроксидом стронция 2) бромоводородной кислотой и оксидом хрома3 3) фосфорной кислотой и цинком 4) серной кислотой и силикатом лития
Скажу сначала общее. Если реакция экзотермическая, значит тепло в процессе реакции выделяется, его много у системы и она отдает это тепло. Т,е нужно отводить тепло системе:) Это как с арбузами летом, их итак много, все объелись уже, а их всё везут и везут- брать никто не будет, выгоды нет:) Насчёт давления: при повышении давления равновесие смещается в ту сторону, где меньше газообразных веществ( точнее их количества- смотрим по коэффициентам)
1) , реакция эндотермическая. При повышении температуры равновесие сместится вправо, т.е в сторону продуктов реакции( тепло системой поглощается, нужно ещё подвести тепло системе) При повышении давления - равновесие вправо. 2) , реакция экзотермическая При повышении температуры-равновесие влево. При повышении давления- равновесие вправо. 3) , реакция эндотермическая При повышении температуры-равновесие вправо. При повышении давления-влево 4) ,реакция экзотермическая При повышении температуры-равновесие влево. При повышении давления- вправо. 5) ,реакция экзотермическая При повышении температуры-равновесие влево. При повышении давления- вправо.
Скажу сначала общее. Если реакция экзотермическая, значит тепло в процессе реакции выделяется, его много у системы и она отдает это тепло. Т,е нужно отводить тепло системе:) Это как с арбузами летом, их итак много, все объелись уже, а их всё везут и везут- брать никто не будет, выгоды нет:)
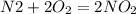 , реакция эндотермическая.
, реакция эндотермическая.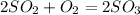 , реакция экзотермическая
, реакция экзотермическая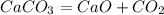 , реакция эндотермическая
, реакция эндотермическая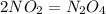 ,реакция экзотермическая
,реакция экзотермическая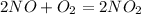 ,реакция экзотермическая
,реакция экзотермическая
Насчёт давления: при повышении давления равновесие смещается в ту сторону, где меньше газообразных веществ( точнее их количества- смотрим по коэффициентам)
1)
При повышении температуры равновесие сместится вправо, т.е в сторону продуктов реакции( тепло системой поглощается, нужно ещё подвести тепло системе)
При повышении давления - равновесие вправо.
2)
При повышении температуры-равновесие влево.
При повышении давления- равновесие вправо.
3)
При повышении температуры-равновесие вправо.
При повышении давления-влево
4)
При повышении температуры-равновесие влево.
При повышении давления- вправо.
5)
При повышении температуры-равновесие влево.
При повышении давления- вправо.
Да не четвертичные углеродные связи,а четвертичные атомы углерода!
CH3 CH3 CH3
| | |
H3 С - С- СH3; H3C- C- CH2-CH2-CH2-CH3;
| | |
CH3 CH3 CH3
CH3
|
H3C- CH2 - C- CH2- CH2- CH3
|
CH3