1. а)У калия б)У натрия (металлические свойства увеличиваются по периоды справа налево, а в группе сверху вниз )
2.Si - кремний
а)IVа группа 3 период
б)+14 Si )2)8)4
в) - кислотный, не растворяется в воде
- кремниевая кислота, малорастворима в воде
3.Металлические(восстановительные), основные свойства усиливаются слева направо (←), неметаллические(окислительные) и кислотные свойства усиливаются справа налево (→), также электроотрицательность усиливается справа налево (→), радиус атома увеличивается слева направо (←)
Пусть количество вещества поглощенного оксида серы х моль. Тогда его масса 80х г. Масса образовавшейся кислоты 98х г. Такие выводы мы сделали из уравнения химической реакции Подставим все это в формулу
1. а)У калия б)У натрия (металлические свойства увеличиваются по периоды справа налево, а в группе сверху вниз )
2.Si - кремний
а)IVа группа 3 период
б)+14 Si )2)8)4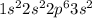
в)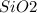 - кислотный, не растворяется в воде
- кислотный, не растворяется в воде
3.Металлические(восстановительные), основные свойства усиливаются слева направо (←), неметаллические(окислительные) и кислотные свойства усиливаются справа налево (→), также электроотрицательность усиливается справа налево (→), радиус атома увеличивается слева направо (←)
4. 12-Магний (Mg) 15-Фосфор (P)
MgO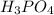
3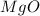 +2
+2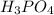 =
=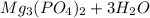
20 г
Объяснение:
Напишем взаимодействие оксида серы с водой (в будущем это нам пригодится)
SO₃ + H₂O = H₂SO₄
Считаем массу начального раствора
m(раствора) = ρ * V(раствора) = 1.8 * 55.6 = 100 г
Считаем массу кислоты в нем
m(H₂SO₄) = w * m(раствора) = 0.91 * 100 = 91 г
Пусть количество вещества поглощенного оксида серы х моль. Тогда его масса 80х г. Масса образовавшейся кислоты 98х г. Такие выводы мы сделали из уравнения химической реакции Подставим все это в формулу
Ну и посчитаем массу оксида серы
m(SO₃) = M(SO₃) * n(SO₃) = 80 * 0.25 = 20 г