4 P+ 5 O2 = 2 P2O5 ( На самом деле: P4 (фосфор- белый) + 5 O2 = P4O10 P.S все немного сложнее) для общего развития реакция идет примерно так но в школе писать не советую, если интересно посмотрите )
P2O5 + H2O = H3PO4 ( опять же реакция для школьной химии )
Номенклатура оксидов. Названия оксидов строится таким образом: сначала произносят слово «оксид», а затем называют образующий его элемент. Если элемент имеет переменную валентность, то она указывается римской цифрой в круглых скобках в конце названия:
NaI2O – оксид натрия; СаIIО – оксид кальция;
SIVO2 – оксид серы (IV); SVIO3 – оксид серы (VI).
При составлении формул оксидов необходимо помнить, что молекула всегда электронейтральна, т.е. она содержит одинаковое число положительных и отрицательных зарядов. Степень окисления кислорода в оксидах всегда – 2. Выравнивание зарядов производят индексами, которые ставят внизу справа у элемента.
   
Характерная степени окисления элементов определяется следующим образом:
I группа – в основном +1,
II группа – в основном +2,
III группа – в основном +3,
IV группа – в основном +2, +4 (четные числа),
V группа – в основном +3, +5 (нечетные числа),
VI группа – в основном +2, +4, +6 (четные числа),
VII группа – в основном +3, +5, +7 (нечетные числа).
Классификация оксидов. По химическим свойствам оксиды делятся на две группы:
1) безразличные – не образуют солей, например: NO, CO,
H2O;
2) солеобразующие, которые, в свою очередь, подразделяются на:
– основные – это оксиды типичных металлов со степенью окисления +1,+2 (I и IIгрупп главных подгрупп, кроме бериллия) и оксиды металлов в минимальной степени окисления, если металл обладает переменной степенью окисления (CrO,MnO);
– кислотные – это оксиды типичных неметаллов (CO2, SO3, N2O5) и металлов в максимальной степени окисления, равной номеру группы в ПСЭ Д.И.Менделеева (CrO3,Mn2O7);
– амфотерные оксиды (обладающие как основными, так и кислотными свойствами, в зависимости от условий проведения реакции) – это оксиды металлов BeO, Al2O3,ZnO и металлов побочных подгрупп в промежуточной степени окисления (Cr2O3,MnO2).
1.1. Основные оксиды
Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами. Основным оксидам соответствуют основания. Например, оксиду кальция CaOотвечает гидроксид кальция Ca(OH)2, оксиду кадмия CdO – гидроксид кадмияCd(OH)2.
Получение
1. Непосредственное взаимодействие металла с кислородом:
2Mg + O2  2MgO.
2. Горение сложных веществ:
2FeS + 3O2  2FeO + 2SO2.
3. Разложение солей кислородсодержащих кислот:
CaCO3  CaO + CO2.
4. Разложение оснований:
Ca(OH)2  CaO + H2O.
Физические свойства
Все основные оксиды – твердые вещества, чаще нерастворимые в воде, окрашенные в различные цвета, например Cu2O –красного цвета, MgO – белого.
Химические свойства
1. Основные оксиды взаимодействуют с водой с образованием оснований. Непосредственно в реакцию соединения с водой вступают только оксиды щелочных и щелочноземельных металлов:
Na2O + H2O → 2NaOH,
CaO + H2O → Ca(OH)2.
2. Взаимодействие с кислотами с образованием соли и воды:
CaO + H2SO4 → CaSO4 + H2O.
3. Взаимодействие с кислотными оксидами с образованием соли:
СaO + SiO2  CaSiO3
4. Взаимодействие с амфотерными оксидами:
СaO + Al2O3 Сa (AlO2)2.
1.2. Кислотные оксиды
Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами. Им соответствуют кислоты. Например, оксиду серы (IV) соответствует сернистая кислота H2SO3. вот это подойдёт?
1 )оксид лития-Li2O
гидроксид натрия NaOH
Серная кислота - H2SO4
Оксид углерода - CO2
2 NaOH + H2SO4= Na2SO4 + 2 H2O
Li2O + H2SO4 = Li2SO4 + H2O
Li2O + CO2 = Li2CO3 ( при нагревании )
CO2 + 2 NaOH(избыток или расплав) = Na2CO3 + H2O
CO2(избыток) + NaOH = NaHCO3
2)
4 P+ 5 O2 = 2 P2O5 ( На самом деле: P4 (фосфор- белый) + 5 O2 = P4O10 P.S все немного сложнее) для общего развития реакция идет примерно так но в школе писать не советую, если интересно посмотрите )
P2O5 + H2O = H3PO4 ( опять же реакция для школьной химии )
3 KOH + H3PO4 = K3PO4 + 3 H2O
K3PO4 + Сa(OH)2 = Ca3(PO4)2↓ + KOH
Ca3(PO4)2 + 3 H2SO4 = 2 H3PO4 + 3 CaSO4
3)
фосфат алюминия- Al PO4
сульфид серебра - Ag2S
оксид марганца - MnO3
гидроксид магния Mn(OH)2
хлорид аммония NH4Cl
нитрат свинца (II) Pb (NO3)2
4)
a) Mg+ CuSO4 = MgSO4 + Cu
4 Mg + 5 H2SO4(концентрированная) = 4 MgSO4 + H2S↑ + 4 H2O
б) CaO+ H2O= Ca(OH)2
Ca(NO3)2 + KOH = KNO3 + Ca(OH)2↓
Ca + H3PO4 = Ca
5) 2AgNO3 + CuCl2 = 2AgCl↓ + Cu(NO3)2
Дано: Решение:
m(AgNO3) = 1,7 г n ( AgNO3) = m/M =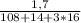 = 0,01 моль = n(AgCl)
= 0,01 моль = n(AgCl)
m ( AgCl) - ? m (AgCl)= n(AgCl) * M(AgCl)= 0,01 моль*
(108г/моль+35,5г/моль) = 1,435 г
ответ: 1,435 г
P.S. n- количество вещества ( еще обозначают как ν - "ню" )
6) CaO + H2SO4 = CaSO4 + H2O
Дано: n (CaO) - ?
m(H2SO4) = 14,7 г
n(H2SO4) = m/M = 14,7 г/ (2г/моль+32г/моль+4*16г/моль) = 0,15 моль=
= n(CaSO4)
m(CaSO4) = n*M = 0,15 моль*(40г/моль + 32г/моль+4*16г/моль)= 15,3 г
7)
Я не могу тут сделать нормальную таблицу, поэтому пусть это таблица : по горизонтали то что мы добавляем в пробирки по вертикали признаки реакции
----- | HNO3 | Ba(NO3)2
Na2CO3 | CO2↑ | помутнение воды
NaNO3 | -- | --
Na2SO4 | -- | осадок
Na2CO3 +2 HNO3 = H2O + CO2↑ + 2NaNO3
NaNO3 + HNO3 ≠
Na2SO4 + HNO3 ≠
Na2CO3 + Ba(NO3)2= BaCO3↓ + 2 NaNO3
Na2SO4 + Ba(NO3)2 = BaSO4↓ + 2 NaNO3
NaI2O – оксид натрия; СаIIО – оксид кальция;
SIVO2 – оксид серы (IV); SVIO3 – оксид серы (VI).
При составлении формул оксидов необходимо помнить, что молекула всегда электронейтральна, т.е. она содержит одинаковое число положительных и отрицательных зарядов. Степень окисления кислорода в оксидах всегда – 2. Выравнивание зарядов производят индексами, которые ставят внизу справа у элемента.
   
Характерная степени окисления элементов определяется следующим образом:
I группа – в основном +1,
II группа – в основном +2,
III группа – в основном +3,
IV группа – в основном +2, +4 (четные числа),
V группа – в основном +3, +5 (нечетные числа),
VI группа – в основном +2, +4, +6 (четные числа),
VII группа – в основном +3, +5, +7 (нечетные числа).
Классификация оксидов. По химическим свойствам оксиды делятся на две группы:
1) безразличные – не образуют солей, например: NO, CO,
H2O;
2) солеобразующие, которые, в свою очередь, подразделяются на:
– основные – это оксиды типичных металлов со степенью окисления +1,+2 (I и IIгрупп главных подгрупп, кроме бериллия) и оксиды металлов в минимальной степени окисления, если металл обладает переменной степенью окисления (CrO,MnO);
– кислотные – это оксиды типичных неметаллов (CO2, SO3, N2O5) и металлов в максимальной степени окисления, равной номеру группы в ПСЭ Д.И.Менделеева (CrO3,Mn2O7);
– амфотерные оксиды (обладающие как основными, так и кислотными свойствами, в зависимости от условий проведения реакции) – это оксиды металлов BeO, Al2O3,ZnO и металлов побочных подгрупп в промежуточной степени окисления (Cr2O3,MnO2).
1.1. Основные оксиды
Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами. Основным оксидам соответствуют основания. Например, оксиду кальция CaOотвечает гидроксид кальция Ca(OH)2, оксиду кадмия CdO – гидроксид кадмияCd(OH)2.
Получение
1. Непосредственное взаимодействие металла с кислородом:
2Mg + O2  2MgO.
2. Горение сложных веществ:
2FeS + 3O2  2FeO + 2SO2.
3. Разложение солей кислородсодержащих кислот:
CaCO3  CaO + CO2.
4. Разложение оснований:
Ca(OH)2  CaO + H2O.
Физические свойства
Все основные оксиды – твердые вещества, чаще нерастворимые в воде, окрашенные в различные цвета, например Cu2O –красного цвета, MgO – белого.
Химические свойства
1. Основные оксиды взаимодействуют с водой с образованием оснований. Непосредственно в реакцию соединения с водой вступают только оксиды щелочных и щелочноземельных металлов:
Na2O + H2O → 2NaOH,
CaO + H2O → Ca(OH)2.
2. Взаимодействие с кислотами с образованием соли и воды:
CaO + H2SO4 → CaSO4 + H2O.
3. Взаимодействие с кислотными оксидами с образованием соли:
СaO + SiO2  CaSiO3
4. Взаимодействие с амфотерными оксидами:
СaO + Al2O3 Сa (AlO2)2.
1.2. Кислотные оксиды
Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами. Им соответствуют кислоты. Например, оксиду серы (IV) соответствует сернистая кислота H2SO3.
вот это подойдёт?