В молекуле озона - три атома, кислорода - два атома. 3,6*10^20 против 2,4*10^13. Очевидно, в данной порции озона атомов больше, чем в данной порции кислорода.
Я не применял формулу = ; поскольку не указаны условия, а известное в пособиях значение константы Vm применяем для нормальных условий.
Історичні відомості про спроби класифiкації хiмічних елементів.
Періодичний закон та періодична система хімічних елементів Д. І. Менделєєва.
Структура періодичної системи
Будова атома (ядро та електронна оболонка).
Сучасне формулювання періодичного закону.
Стан електронів у атомі.
Взаємозв’язок між розмiщенням елементів
Характеристика хiмічних елементів
Електронна природа хiмічного зв’язку
Ковалентний зв’язок, його види — полярний і неполярний.
Йонний зв’язок
Кристалічні ґратки.
Ступінь окиснення.
Copyright © 2011-2015 Школяр України.
All Rights Reserved.
В порции озона. 3,6*10^20 против 2,4*10^13.
Объяснение:
Итак, основная формула - применяемая в этой задаче
N =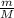 *Na, Na - число Авогадро, равное 6,022*10^23 моль⁻1, а N - число молекул
*Na, Na - число Авогадро, равное 6,022*10^23 моль⁻1, а N - число молекул
Для озона все проще - 0,0096 г/46 г/моль * 6,022*10^23 моль⁻1, ≈ 1,2044*10^20
Для кислорода все на шаг дольше, поскольку дан объем, а не масса. Эти две величины связаны соотношением V =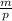 , отсюда m = V*p
, отсюда m = V*p
N =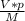 *Na = (0,00000448 м^3* 0,00143 г/м^3) * 6,022*10^23 моль⁻1, /32 г/моль ≈ 1,2056*10^13
*Na = (0,00000448 м^3* 0,00143 г/м^3) * 6,022*10^23 моль⁻1, /32 г/моль ≈ 1,2056*10^13
В молекуле озона - три атома, кислорода - два атома. 3,6*10^20 против 2,4*10^13. Очевидно, в данной порции озона атомов больше, чем в данной порции кислорода.
Я не применял формулу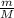 =
= 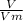 ; поскольку не указаны условия, а известное в пособиях значение константы Vm применяем для нормальных условий.
; поскольку не указаны условия, а известное в пособиях значение константы Vm применяем для нормальных условий.