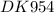Напишите уравнения реакций в молекуляной и ионной форме при которых можно осуществить превращения по схеме Cr→Cr2(so4)3 → Cr(NO3)3 → Cr(Oh)3→li3[Cr(oh)6]
Виключно велике значення періодичний закон мав для визначення загальних понять хімії, як, наприклад, «валентність» або «атомність», як її тоді називали, а також для визначення понять хімічний елемент «перекисні», «двоокисні» тощо.Перш за все періодичний закон дав можливість не тільки більш точно визначити місце для багатьох елементів, таких як уран, торій, індій, берилій, германій і т.д. у системі, але й встановити та виправити для них ряд властивостей і, в першу чергу, атомну масу і валентність. Наприклад, для елемента індію до Менделєєва був відомий лише еквівалент 38,253.
Дано:
V(р-ра CaCl₂) = 150 мл
ω(CaCl₂) = 16%
ρ(р-ра CaCl₂) = 1,14 гр/мл
-----------------------------------------
Найти:
m(CaCl₂ · 6H₂O) - ?
m(H₂O необ.) - ?
1) Для начала мы запишем уравнение реакций, именно по такой уравнений мы будем пользоваться:
CaCl₂ + 6H₂O → CaCl₂ · 6H₂O
2) Далее находим массу у хлорида кальция:
m(р-ра CaCl₂) = V(р-ра CaCl₂) × ρ(р-ра CaCl₂) = 150 мл × 1,14 гр/мл = 171 гр
m(CaCl₂) = m(р-ра CaCl₂)×ω(CaCl₂)/100% = 171 гр × 16%/100% = 171 гр × 0,16 = 27,36 гр
3) Теперь находим количества вещества у хлорида кальция, потом воды в кристаллогидрате по уравнению реакций:
M(CaCl₂) = 40 + 35,5×2 = 40 + 71 = 111 гр/моль
n(CaCl₂) = m(CaCl₂)/M(CaCl₂) = 27,36 гр / 111 гр/моль ≈ 0,25 моль ⇒ n(H₂O) = 6n(CaCl₂) = 6×0,25 моль = 1,5 моль
4) Теперь находим массу воды:
M(H₂O) = 1×2 + 16 = 2 + 16 = 18 гр/моль
m(H₂O) = n(H₂O) × M(H₂O) = 1,5 моль × 18 гр/моль = 27 гр
5) Теперь находим массу кристаллогидрата:
m(CaCl₂ · 6H₂O) = m(CaCl₂) + m(H₂O) = 27,36 гр + 27 гр = 54,36 гр
ответ: m(H₂O) = 27 гр
m(CaCl₂ · 6H₂O) = 54,36 гр
Решено от :