Найти массу осадка , который образуется при взаимодействии 600г 30%-ного раствора гидроксида кальция с углекислым газом. Сколько литров газа потребуется, чтобы реакция полностью?
Сейчас начнем решать это, просто примите как аксиому, что числа x и y, что мы найдем МОЖНО пропорционально увеличивать, то есть умножить или разделить на какое-то число, к примеру, если , то тоже будет верным, однако ответ все же конкретный, мы с вами воспользуемся этим в решении, перейдем к нему:
Нам не известен класс сгораемого вещества, запишем общую формулу горения углеводородов:
Вы сами можете прекрасно вывести эту формулу
Пусть мы имеем y атомов водорода, тогда согласно формуле, в воде у нас будет 0.5y атомов кислорода, запишем молярную массу воды
Из стехиометрического закона отношение коэффициентов перед веществами равно отношению количеств веществ, применим закон к CxHy и H2O
По тому же принципу, что и раньше молярная масса CxHy равняется
Количество вещества равняется масса (даны по условию) делить на молярную массу (для воды знаем, для углеводорода нашли)
Запишем закон:
Решив уравнение получим, что
Напоминаю что числа x, y всего лишь коэффициенты, и их можно домножить
Домножим на знаменатель нецелой дроби, чтобы получить целые числа
Теперь, получив целые числа мы можем сказать, что формула вещества , выполним проверку, подставив значения:
Если домножить на два, то получим классическое уравнение с целыми коэффициентами:
По закону стехиометрии проверяется что при сгорании 4.3 грамм вещества ДЕЙСТВИТЕЛЬНО образуется 6.3 грамма воды
Найдем структурную формулу:
Два атома соединены с тремя атомами углерода, выполнить это можно единственной конфигурацией, разместив в цепочке из 4 атомов углерода два метила к 2 и 3 атомам углерода, и получив диизопропил или 2,3-диметилбутан
Диизопропил
2,3-диметилбутан
Объяснение:
Сейчас начнем решать это, просто примите как аксиому, что числа x и y, что мы найдем МОЖНО пропорционально увеличивать, то есть умножить или разделить на какое-то число, к примеру, если , то
, то 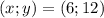 тоже будет верным, однако ответ все же конкретный, мы с вами воспользуемся этим в решении, перейдем к нему:
тоже будет верным, однако ответ все же конкретный, мы с вами воспользуемся этим в решении, перейдем к нему:
Нам не известен класс сгораемого вещества, запишем общую формулу горения углеводородов:
Вы сами можете прекрасно вывести эту формулу
Пусть мы имеем y атомов водорода, тогда согласно формуле, в воде у нас будет 0.5y атомов кислорода, запишем молярную массу воды
Из стехиометрического закона отношение коэффициентов перед веществами равно отношению количеств веществ, применим закон к CxHy и H2O
По тому же принципу, что и раньше молярная масса CxHy равняется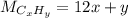
Количество вещества равняется масса (даны по условию) делить на молярную массу (для воды знаем, для углеводорода нашли)
Запишем закон:
Решив уравнение получим, что
Напоминаю что числа x, y всего лишь коэффициенты, и их можно домножить
Домножим на знаменатель нецелой дроби, чтобы получить целые числа
Теперь, получив целые числа мы можем сказать, что формула вещества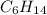 , выполним проверку, подставив значения:
, выполним проверку, подставив значения:
Если домножить на два, то получим классическое уравнение с целыми коэффициентами:
По закону стехиометрии проверяется что при сгорании 4.3 грамм вещества ДЕЙСТВИТЕЛЬНО образуется 6.3 грамма воды
Найдем структурную формулу:
Два атома соединены с тремя атомами углерода, выполнить это можно единственной конфигурацией, разместив в цепочке из 4 атомов углерода два метила к 2 и 3 атомам углерода, и получив диизопропил или 2,3-диметилбутан
Вещество состава C₆H₁₄ - 2,3-диметилбутан.
Объяснение:
Исходя из условия считаем, что углеводород состоит только из атомов углерода и водорода, в противном случае в условии задачи недостаточно данных.
Известно, что выделилось 6,3 г воды.
Молярная масса воды:
M(H₂O) = 2 + 16 = 18 г/моль.
Найдем количество вещества выделившейся воды:
Согласно формуле 1 моль воды содержит 2 моль атомов водорода.
Тогда 0,35 моль воды содержит 0,7 моль водорода, и столько же моль водорода содержит углеводород.
Масса атомов водорода m(H) = 0,7 моль · 1 г/моль = 0,7 грамм.
Тогда исходный углеводород содержит 0,7 г водорода и
4,3 г - 0,7 г = 3,6 г углерода.
Тогда отношение числа молей атомов углерода и водорода в исходном углеводороде:
При n(С) = 3 имеем структуру состава C₃H₇- это радикал, пропил, часть молекулы с одной свободной связью.
при n(С) = 6 состав вещества C₆H₁₄, что соответствует составу предельных углеводородов CₙH₂ₙ₊₂.
Исходное вещество является изомером гексана, так как по условию его молекула содержит два третичных атома углерода.
2,3-диметилбутан.