НЕ Во вторую
В тетради запиши только ответы под цифрами 1,2,3.
Вы
В первук пробирку налили гидроксид натрия, формула кторого 1
раб
который является 1
ик нему добавили фенолфталеиновый
IIPIL
индикатор, который из менил свой цвет и стал 3
KYH
пробирку налили серной кислоты, формула которой 4
и добавили | воск
лаклус, который изменил свой цвет и стал 5
После того как
(суба
соединили пробирки 1 и 2 произошла реакция 6
B Pesuhtete
которой образовалась 7
и 8
При добавлении к раствору | срок!
(полученному при сливании) метилового оранжевого, индикатор свой цвет
9
так как среда раствора стала 10
край
Пройти уроки билимленд 17.12.2020 г «Природные кислоты и щелочи.
В одну стадию нельзя получить этиленгликоль из этанола, поэтому в каждом несколько реакций.
1. Получение по цепочке этанол ⇒ хлорэтан ⇒ винилхлорид ⇒ 1,2-дихлорэтан ⇒ этиленгликоль.
1. Реакция взаимодействия этанола с хлороводородом:
ᅠᅠ
2. Реакция дегидрирования хлорэтана при нагревании и в присутствии Никеля:
ᅠᅠ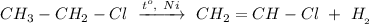
3. Реакция присоединения хлороводорода против правила Марковникова в присутствии пероксида водорода:
ᅠᅠ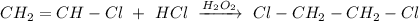
4. Щелочной гидролиз 1,2-дихлорэтана при нагревании водным раствором щёлочи, получаем этиленгликоль:
ᅠᅠ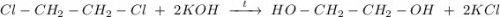
2. Получение по цепочке этанол ⇒ этен ⇒ эпоксид этилена ⇒ этиленгликоль.
1. Реакция внутримолекулярной дегидратации этанола при нагревании свыше 140 градусов и в присутствии концентрированной серной кислоты:
ᅠᅠ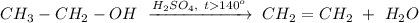
2. Реакция окисления этилена кислородом воздуха в присутствии ионов серебра:
ᅠᅠ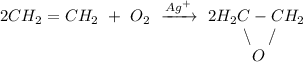
3. Гидролиз эпоксида в кислой среде при нагревании, получение этиленгликоля:
ᅠᅠ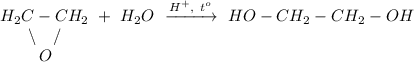
3. Получение по цепочке этанол ⇒ этилен ⇒ этиленгликоль.
1. Реакция внутримолекулярной дегидратации этанола при нагревании свыше 140 градусов и в присутствии концентрированной серной кислоты:
ᅠᅠ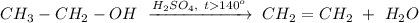
2. Реакция окисления этилена перманганатом калия в нейтральной среде при температуре в 0 градусов:
Объяснение:
1)1) Будет растворяться железо, т. к. его потенциал окисления-восстановления меньше(-0.44 В), чем у никеля(-0.25 В). Поэтому растворяться будет железо, а водородная деполяризация(т. е. выделение водорода, разрядка протонов) - на никеле.
2)Количество поглощенного водорода зависит от состояния поверхности металла и от температуры. Порошкообразные металлы и при температуре более высокой до известного предела поглощают больше водорода, чем сплошные и на холоду. Серебро, медь, железо, золото, платина в сплошном виде и при обыкновенной температуре поглощают на один объем металла менее одного объема водорода.
3)Электролиз расплава NaCl:
NaCl ⇄ Na+ + Cl-
K(-): Na+ + 1e → Na0
A(+): 2Cl- - 2e → Cl20
Вывод: 2NaCl → 2Na + Cl2