Описать по псэ элемент n3 ( место положения в псэ, электронную и графическую формулы, количество нейтронов, протонов, электронов, возможные степени окисления, высшие кислородные и водородный соединения (если дать характеристику этому элементу.
Сила кислоты определяется ее отделять протоны. В HF существуют водородные связи, что образования димеров , поэтому протоны отсоединяются плохо и HF слабая кислота. Вода, насколько мы знаем вообще кислота такая себе, в том смысле, что она, конечно отделять протоны (это называется автопротолиз воды), но кислота более сильная. Аммиак же еще худшая кислота, чем вода, вернее сказать, он вообще является основанием: у молекулы аммиака есть неподеленная пара электронов, которую она при желании может поместить на пустую орбиталь протона, что и характеризует ее как молекулу основания.
Верными являются варианты 2 и 4. HI, как ни странно, одна из самых сильных кислот. Она сильнее кислоты HBr, потому что сила межяжерного притяжения протона и йода меньше, чем протона и брома (бром более электроотрицателен), следовательно в HI протон уходит лучше, значит и кислота сильнее. 4 вариант вы отметили абсолютно верно является слабой кислотой даже при диссоциации по первой ступени.
1) Если элемент находится в группе VA, то его водородное соединение имеет формулу RН₃.
2) Возьмём 1 моль этого соединения. Массовая доля водорода в соединении - 0,17647 долей и масса его в этом 1 моле равна 3*1 = 3 грамма. А массовая доля неизвестного элемента равна:
1 - 0,17647 = 0,82353
3) Составляем пропорцию:
3 г 0,17647
Х г 0,82353
Х = 3*0,82353/0,17647 = 14 г
3) В молекуле данного соединения неизвестный элемент представлен 1 атомом, значит, молярная масса этого элемента равна 14 г/моль. Смотрим в таблицу Менделеева: такую массу имеет Азот. Он находится во 2 периоде, значит число энергетических уровней (электронных слоёв) в атоме равно 2.
Сила кислоты определяется ее отделять протоны. В HF существуют водородные связи, что образования димеров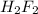 , поэтому протоны отсоединяются плохо и HF слабая кислота. Вода, насколько мы знаем вообще кислота такая себе, в том смысле, что она, конечно отделять протоны (это называется автопротолиз воды), но
, поэтому протоны отсоединяются плохо и HF слабая кислота. Вода, насколько мы знаем вообще кислота такая себе, в том смысле, что она, конечно отделять протоны (это называется автопротолиз воды), но 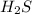 кислота более сильная. Аммиак же еще худшая кислота, чем вода, вернее сказать, он вообще является основанием: у молекулы аммиака есть неподеленная пара электронов, которую она при желании может поместить на пустую орбиталь протона, что и характеризует ее как молекулу основания.
кислота более сильная. Аммиак же еще худшая кислота, чем вода, вернее сказать, он вообще является основанием: у молекулы аммиака есть неподеленная пара электронов, которую она при желании может поместить на пустую орбиталь протона, что и характеризует ее как молекулу основания.
Верными являются варианты 2 и 4. HI, как ни странно, одна из самых сильных кислот. Она сильнее кислоты HBr, потому что сила межяжерного притяжения протона и йода меньше, чем протона и брома (бром более электроотрицателен), следовательно в HI протон уходит лучше, значит и кислота сильнее. 4 вариант вы отметили абсолютно верно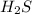 является слабой кислотой даже при диссоциации по первой ступени.
является слабой кислотой даже при диссоциации по первой ступени.
1) Если элемент находится в группе VA, то его водородное соединение имеет формулу RН₃.
2) Возьмём 1 моль этого соединения. Массовая доля водорода в соединении - 0,17647 долей и масса его в этом 1 моле равна 3*1 = 3 грамма. А массовая доля неизвестного элемента равна:
1 - 0,17647 = 0,82353
3) Составляем пропорцию:
3 г 0,17647
Х г 0,82353
Х = 3*0,82353/0,17647 = 14 г
3) В молекуле данного соединения неизвестный элемент представлен 1 атомом, значит, молярная масса этого элемента равна 14 г/моль. Смотрим в таблицу Менделеева: такую массу имеет Азот. Он находится во 2 периоде, значит число энергетических уровней (электронных слоёв) в атоме равно 2.
ответ: Два