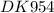Определить количество атомов,структурных единиц а так же массовые доли каждого элемента в амиаке (NH3) в составе образца объемом 24 дм3 и этанола (C2H5OH) массой 48 г
такое количество вещества равно условно. Так записывают при учете коэффициента при расчете индексов чаще всего в формулах органических веществ.
в задачах по продуктам горения находят формулы орг.веществ. Запись общего уравнение горения такая:
CxHy + O2 = xCO2 + x\2H2
Вывели его по закономерности: чтобы расставить коэффициенты в формуле. Смотрят индекс углерода, и такой же соответствующий коэффициент ставят перед углеродом в СО2. Количество вещества по уравнению соответствует коэффициентам.
то есть если например, горит этан С2H6 + ...--- 2СО2 + ...
поэтому и записывают n(C) = n(CO2) или х(С) = х (СО2)
например решим задачу: при горении орг.вещества массой 3,6 г выделился углекислый газ объемом 5,6 л
Дано:
m (в-ва) = 3,6 г
V (CO2) = 5,6 л
Найти: CxHy
записываем общее уравнение горения
CxHy + O2 = xCO2 + 1\2yH2O
находим количества вещества выделившегося углекислого газа по его известному объему:
n(CO2) = V\Vm = 5,6 г/ 22,4 л\моль = 0,25моль;
если в реакцию горения образовалось 0,25 моль СО2, то и изначально углерода было 0,25 моль
n(СО2) = n(C) = 0,25 моль.
по массе это:
m(C) = 0,25 • 12 = 3 г
Рассчитаем сколько тогда сколько было водорода по массе:
m(Н) = 3,6 – 3 = 0,6 г
его количество вещества соответственно равно:
ν(Н) = m /M = 0,6 / 1 = 3,2 моль.
сравниваем соотношения в формуле количества данных элементов:
1) Для начала мы запишем уравнение реакций растворов то что известно в условий задачи:
Ba(NO₃)₂ + K₂CrO₄ → BaCrO₄↓ + 2KNO₃
2) Далее мы напишем формулу про произведение реакций у осадка, а потом находим в таблице осадка который образовался, при него мы определим будет ли этот осадок в перенасыщенном растворе:
BaCrO₄ → Ba²⁺ + CrO₄²⁻
ПР = [Ba²⁺]×[CrO₄²⁻] ПР(BaCrO₄) = 1,17×10⁻¹⁰ (в таблице)
3) При смешении равных объемов растворов Ba(NO₃)₂ и K₂CrO₄ объем смеси увеличивается в 2 раза, а концентрация каждого из ионов уменьшается в 2 раза. Следовательно:
[Ba²⁺] = 1/2 × Cm(Ba(NO₃)₂) = 1/2 × 0,001 М = 0,0005 М
[CrO₄²⁻] = 1/2 × Cm(K₂CrO₄) = 1/2 × 0,01 М = 0,005 М
4) Далее находим произведение реакций у осадка в полученных концентрациях и потом сравниваем произведение реакций осадок в таблице:
Объяснение:
такое количество вещества равно условно. Так записывают при учете коэффициента при расчете индексов чаще всего в формулах органических веществ.
в задачах по продуктам горения находят формулы орг.веществ. Запись общего уравнение горения такая:
CxHy + O2 = xCO2 + x\2H2
Вывели его по закономерности: чтобы расставить коэффициенты в формуле. Смотрят индекс углерода, и такой же соответствующий коэффициент ставят перед углеродом в СО2. Количество вещества по уравнению соответствует коэффициентам.
то есть если например, горит этан С2H6 + ...--- 2СО2 + ...
поэтому и записывают n(C) = n(CO2) или х(С) = х (СО2)
например решим задачу: при горении орг.вещества массой 3,6 г выделился углекислый газ объемом 5,6 л
Дано:
m (в-ва) = 3,6 г
V (CO2) = 5,6 л
Найти: CxHy
записываем общее уравнение горения
CxHy + O2 = xCO2 + 1\2yH2O
находим количества вещества выделившегося углекислого газа по его известному объему:
n(CO2) = V\Vm = 5,6 г/ 22,4 л\моль = 0,25моль;
если в реакцию горения образовалось 0,25 моль СО2, то и изначально углерода было 0,25 моль
n(СО2) = n(C) = 0,25 моль.
по массе это:
m(C) = 0,25 • 12 = 3 г
Рассчитаем сколько тогда сколько было водорода по массе:
m(Н) = 3,6 – 3 = 0,6 г
его количество вещества соответственно равно:
ν(Н) = m /M = 0,6 / 1 = 3,2 моль.
сравниваем соотношения в формуле количества данных элементов:
C : H = 3 : 0,6 = 3 : 8
Простейшая формула — С3Н8
1) Для начала мы запишем уравнение реакций растворов то что известно в условий задачи:
Ba(NO₃)₂ + K₂CrO₄ → BaCrO₄↓ + 2KNO₃
2) Далее мы напишем формулу про произведение реакций у осадка, а потом находим в таблице осадка который образовался, при него мы определим будет ли этот осадок в перенасыщенном растворе:
BaCrO₄ → Ba²⁺ + CrO₄²⁻
ПР = [Ba²⁺]×[CrO₄²⁻] ПР(BaCrO₄) = 1,17×10⁻¹⁰ (в таблице)
3) При смешении равных объемов растворов Ba(NO₃)₂ и K₂CrO₄ объем смеси увеличивается в 2 раза, а концентрация каждого из ионов уменьшается в 2 раза. Следовательно:
[Ba²⁺] = 1/2 × Cm(Ba(NO₃)₂) = 1/2 × 0,001 М = 0,0005 М
[CrO₄²⁻] = 1/2 × Cm(K₂CrO₄) = 1/2 × 0,01 М = 0,005 М
4) Далее находим произведение реакций у осадка в полученных концентрациях и потом сравниваем произведение реакций осадок в таблице:
ПР = [Ba²⁺]×[CrO₄²⁻] = 0,0005 × 0,005 = 0,0000025 = 2,5×10⁻⁶
Следовательно:
ПР > ПР(BaCrO₄) = 2,5×10⁻⁶ > 1,17×10⁻¹⁰ ⇒ осадок будет образовываться
ответ: Осадок будет образовываться
Решено от :