Опыт 1.докажите, что вам выдан раствор сульфата железа (II)
ОПЫТ 2.В четырёх пробирках находятся растворы: серной кислоты, хлорида натрия, фосфата натрия, нитрата калия. Используя результаты эксперимента по определению выданных веществ, представленных в таблице, объясните и подтвердите соответствующими уравнениями реакций в молекулярном, полном и сокращённом ионном виде, в какой пробирке какое вещество.
Формула любого высшего оксида, составляется на основании его высшей степени окисления, т.е. у любого элемента, будь то магний, будь то азот(исключение - фтор, благородные газы и неамфотерные металлы) есть степень окисления(СО)
Вот магний - элемент второй группы, главной подгруппы, его высшая СО = +2, у кислорода СО всегда -2, значит оксид выглядит: MgO, как составить гидроксид, так же!
В состав гидроксидов входит OH - группа, у нее заряд минус, берем магний, и сравниваем их заряды, у магния +2, значит на один магний с зарядом +2, приходится 2 OH группы, формула:
Mg(OH)2
С неметаллами, в частности с азотом - сложнее. У него есть несколько СО
-3, 0,+1, +2, +3, +4, +5
Конечно высшая СО будет +5
Теперь как разобраться с индексами.
Сначала состроим формулу - скелет:
NO
Теперь расставим СО у элементов: - находим общее кратное, у 5 и 2 это - 10, и теперь надо это кратное, разделить на СО азота и СО кислорода, получим - 2 и 5, строим формулу: N2O5
Высший гидроксид оксидов неметаллов - кислота, у N2O5 - HNO3
Na2O - NaOH - оксид и гидроксид натрия MgO - Mg(OH)2 - оксид и гидроксид магния Al2O3 - Al(OH)3 - оксид и гидроксид алюминия (амфотерные) SiO2 - H2SiO3 - оксид кремния (4) и метакремниевая кислота P2O5 - H3PO4 - оксид фосфора (5) и ортофосфорная кислота SO3 - H2SO4 - оксид серы (6) и серная кислота Cl2O7 - HClO4 - оксид хлора (7) и хлорная кислота
При переходе от натрия к хлору основные свойства этих соединений ослабляются, а кислотные - усиливаются: гидроксид натрия - щелочь, гидроксид магния - слабое основание, гидроксид алюминия - амфотерен, гидроксид кремния (4) - слабая кислота, гидроксид фосфора (5) - кислота средней силы, гидроксиды серы (6) и хлора (7) - сильные кислоты.
Формула любого высшего оксида, составляется на основании его высшей степени окисления, т.е. у любого элемента, будь то магний, будь то азот(исключение - фтор, благородные газы и неамфотерные металлы) есть степень окисления(СО)
Вот магний - элемент второй группы, главной подгруппы, его высшая СО = +2, у кислорода СО всегда -2, значит оксид выглядит: MgO, как составить гидроксид, так же!
В состав гидроксидов входит OH - группа, у нее заряд минус, берем магний, и сравниваем их заряды, у магния +2, значит на один магний с зарядом +2, приходится 2 OH группы, формула:
Mg(OH)2
С неметаллами, в частности с азотом - сложнее. У него есть несколько СО
-3, 0,+1, +2, +3, +4, +5
Конечно высшая СО будет +5
Теперь как разобраться с индексами.
Сначала состроим формулу - скелет:
NO
Теперь расставим СО у элементов:
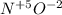 - находим общее кратное, у 5 и 2 это - 10, и теперь надо это кратное, разделить на СО азота и СО кислорода, получим - 2 и 5, строим формулу:
- находим общее кратное, у 5 и 2 это - 10, и теперь надо это кратное, разделить на СО азота и СО кислорода, получим - 2 и 5, строим формулу:
N2O5
Высший гидроксид оксидов неметаллов - кислота, у N2O5 - HNO3
Na2O - NaOH - оксид и гидроксид натрия
MgO - Mg(OH)2 - оксид и гидроксид магния
Al2O3 - Al(OH)3 - оксид и гидроксид алюминия (амфотерные)
SiO2 - H2SiO3 - оксид кремния (4) и метакремниевая кислота
P2O5 - H3PO4 - оксид фосфора (5) и ортофосфорная кислота
SO3 - H2SO4 - оксид серы (6) и серная кислота
Cl2O7 - HClO4 - оксид хлора (7) и хлорная кислота
При переходе от натрия к хлору основные свойства этих соединений ослабляются, а кислотные - усиливаются: гидроксид натрия - щелочь, гидроксид магния - слабое основание, гидроксид алюминия - амфотерен, гидроксид кремния (4) - слабая кислота, гидроксид фосфора (5) - кислота средней силы, гидроксиды серы (6) и хлора (7) - сильные кислоты.
Доказательство амфотерности гидроксида алюминия:
1. Взаимодействие с кислотами (основные свойства)
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O
2. Взаимодействие со щелочами (кислотные свойства)
Al(OH)3 + NaOH + 2H2O = Na[Al(OH)4(Н2О)2]
Al(OH)3 + 3KOH = K3[Al(OH)6] (в растворе)