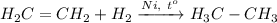Отношение метана к бромной воде и водному раствору перманганата калия. 1) в первую пробирку наливают 4-5 мл бромной воды.(раствор должен быть светло-желтым) 2) во вторую пробирку наливают 4-5 мл раствора перманганата калия (раствор должен быть светло- розовым) 3) газоотводную трубку с выделяющимся метаном опускают поочередно в эти пробирки так, чтобы газ пробулькивал через весь раствор. устанавливают, изменяется ли окраска этих растворов, выделяющимся метаном, т.е. происходит ли бромирование или окисление (при комнатной температуре). результат наблюдения запишите в виде уравнения реакций взаимодействия метана с бромной водой и перманганатом калия при нормальных условиях.
Оксид магния взаимодействует с водой (лучше с горячей) образует гидроксид магния - основание
MgO + H₂O= Mg(OH)₂↓
Оксид магния взаимодействует с кислотами с образованием соли и воды:
MgO + H₂SO₄ = MgSO₄ + H₂O
2) Оксиду магния соответствует основание гидроксид магния Mg(OH)₂.
Гидроксид магния диссоциировать не будет, так как он нерастворим в воде.
3) CaBr₂ - бромид кальция, это соль бромводородной кислоты.
Fe(HSO₄)₂ - кислый сульфат железа(ll). Соль серной кислоты.
4. Цинкат кали K₂Zn(OH)₄
K₂Zn(OH)₄ ⇄ 2K⁺ + Zn(OH)₄²⁻
Гидрофосфат магния MgHPO₄
MgHPO₄⇄ Mg²⁺ + HPO₄²⁻
1. Получение этилена из этана. Для этого требуется провести реакцию дегидрирования этана при температуре 300 градусов и катализаторе Cr₂O₃:
ᅠᅠ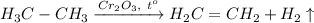
2. Получение 1,2-дибромэтана из этена. Для этого требуется провести реакцию бромирования этилена:
ᅠᅠ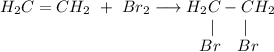
3. Получение этилена из 1,2-дибромэтана. Для этого требуется провести дегалогенирование дигалогеналканов в реакции с цинком при нагревании:
ᅠᅠ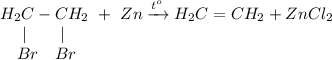
4. Получение этанола из этилена. Для этого требуется провести реакцию гидратации этилена при нагревании и кат. H₃PO₄:
ᅠᅠ
5. Получение этилена из этанола. Для этого требуется провести реакцию внутримолекулярной дегидратации спирта при температуре свыше 140 градусов и при кат. H₂SO₄:
ᅠᅠ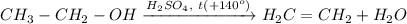
6. Получение этана из этилена. Для этого требуется провести реакцию гидрирования этилена при нагревании и кат. Ni:
ᅠᅠ